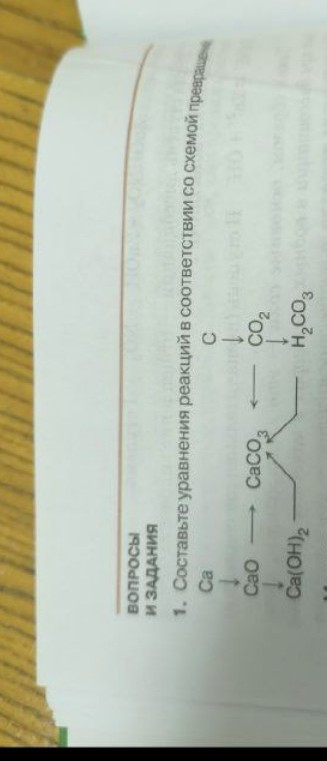
ВОПРОСЫ И ЗАДАНИЯ
1. Составьте уравнения реакций в соответствии со схемой превращений.
На схеме представлены две независимые цепочки превращений:
Цепочка 1:
\[ \text{Ca} \rightarrow \text{CaO} \rightarrow \text{Ca(OH)}_2 \rightarrow \text{CaCO}_3 \]
\[ \text{CaCO}_3 \leftarrow \text{CO}_2 \leftarrow \text{C} \]
Цепочка 2:
\[ \text{C} \rightarrow \text{CO}_2 \rightarrow \text{H}_2\text{CO}_3 \]
\[ \text{H}_2\text{CO}_3 \rightarrow \text{CaCO}_3 \]
Давайте составим уравнения реакций для каждой цепочки.
Цепочка 1: Превращения кальция и его соединений
1. Превращение Ca в CaO:
Кальций (Ca) реагирует с кислородом (O2) при нагревании, образуя оксид кальция (CaO).
\[ 2\text{Ca} + \text{O}_2 \xrightarrow{t} 2\text{CaO} \]
2. Превращение CaO в Ca(OH)2:
Оксид кальция (CaO), также известный как негашеная известь, реагирует с водой (H2O), образуя гидроксид кальция (Ca(OH)2), или гашеную известь. Эта реакция сопровождается выделением большого количества теплоты.
\[ \text{CaO} + \text{H}_2\text{O} \rightarrow \text{Ca(OH)}_2 \]
3. Превращение Ca(OH)2 в CaCO3:
Гидроксид кальция (Ca(OH)2) реагирует с углекислым газом (CO2), образуя карбонат кальция (CaCO3) и воду (H2O). Это реакция, которая происходит при "помутнении" известковой воды.
\[ \text{Ca(OH)}_2 + \text{CO}_2 \rightarrow \text{CaCO}_3 \downarrow + \text{H}_2\text{O} \]
4. Превращение C в CO2:
Углерод (C) сгорает в избытке кислорода (O2), образуя углекислый газ (CO2).
\[ \text{C} + \text{O}_2 \xrightarrow{t} \text{CO}_2 \]
5. Превращение CO2 в CaCO3 (через Ca(OH)2):
Углекислый газ (CO2) может быть использован для получения карбоната кальция (CaCO3) из гидроксида кальция (Ca(OH)2), как показано в пункте 3.
\[ \text{CO}_2 + \text{Ca(OH)}_2 \rightarrow \text{CaCO}_3 \downarrow + \text{H}_2\text{O} \]
Цепочка 2: Превращения углерода и его соединений
1. Превращение C в CO2:
Углерод (C) сгорает в избытке кислорода (O2), образуя углекислый газ (CO2).
\[ \text{C} + \text{O}_2 \xrightarrow{t} \text{CO}_2 \]
2. Превращение CO2 в H2CO3:
Углекислый газ (CO2) растворяется в воде (H2O), образуя угольную кислоту (H2CO3). Эта реакция обратима, и угольная кислота является слабой и неустойчивой.
\[ \text{CO}_2 + \text{H}_2\text{O} \rightleftharpoons \text{H}_2\text{CO}_3 \]
3. Превращение H2CO3 в CaCO3:
Угольная кислота (H2CO3) реагирует с соединениями кальция, например, с гидроксидом кальция (Ca(OH)2), образуя карбонат кальция (CaCO3) и воду (H2O).
\[ \text{H}_2\text{CO}_3 + \text{Ca(OH)}_2 \rightarrow \text{CaCO}_3 \downarrow + 2\text{H}_2\text{O} \]
Или с оксидом кальция (CaO):
\[ \text{H}_2\text{CO}_3 + \text{CaO} \rightarrow \text{CaCO}_3 \downarrow + \text{H}_2\text{O} \]
Таким образом, мы составили все уравнения реакций для обеих цепочек превращений.