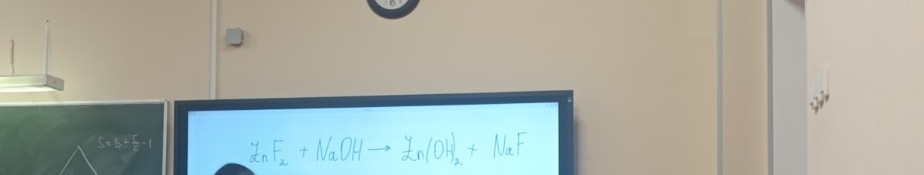Хорошо, давайте разберем эту задачу.
На изображении показано химическое уравнение:
\(ZnF_2 + NaOH \rightarrow Zn(OH)_2 + NaF\)
Это реакция обмена между фторидом цинка и гидроксидом натрия. В результате образуется гидроксид цинка и фторид натрия.
Для того чтобы написать полное и сокращенное ионные уравнения, нам нужно определить, какие из этих веществ являются сильными электролитами (растворимыми солями, сильными кислотами или сильными основаниями) и диссоциируют в водном растворе на ионы.
1.
Определяем растворимость веществ:
* \(ZnF_2\) (фторид цинка) — малорастворимая соль.
* \(NaOH\) (гидроксид натрия) — сильное основание, хорошо растворимо.
* \(Zn(OH)_2\) (гидроксид цинка) — нерастворимое основание (выпадает в осадок).
* \(NaF\) (фторид натрия) — растворимая соль.
2.
Записываем полное ионное уравнение:
В полном ионном уравнении мы записываем в виде ионов только те вещества, которые являются сильными электролитами и растворимы в воде. Нерастворимые вещества, газы и слабые электролиты записываются в молекулярной форме.
Сначала уравняем исходное молекулярное уравнение:
\(ZnF_2 + 2NaOH \rightarrow Zn(OH)_2 \downarrow + 2NaF\)
Теперь запишем его в ионной форме, учитывая растворимость и диссоциацию:
\(ZnF_2\) — малорастворимая соль, поэтому записываем её в молекулярной форме.
\(NaOH\) — сильное основание, диссоциирует на \(Na^+\) и \(OH^-\).
\(Zn(OH)_2\) — нерастворимое основание, выпадает в осадок, поэтому записываем его в молекулярной форме.
\(NaF\) — растворимая соль, диссоциирует на \(Na^+\) и \(F^-\).
Полное ионное уравнение:
\[ZnF_2 (тв) + 2Na^+ (р-р) + 2OH^- (р-р) \rightarrow Zn(OH)_2 (тв) + 2Na^+ (р-р) + 2F^- (р-р)\]
(Здесь "тв" означает твердое вещество, "р-р" означает раствор)
3.
Записываем сокращенное ионное уравнение:
Для получения сокращенного ионного уравнения мы убираем из полного ионного уравнения те ионы, которые присутствуют как в левой, так и в правой части уравнения в неизменном виде (так называемые "зрительские" ионы).
В нашем полном ионном уравнении:
\[ZnF_2 (тв) + 2Na^+ (р-р) + 2OH^- (р-р) \rightarrow Zn(OH)_2 (тв) + 2Na^+ (р-р) + 2F^- (р-р)\]
"Зрительскими" ионами являются \(Na^+\).
Убираем их:
\[ZnF_2 (тв) + 2OH^- (р-р) \rightarrow Zn(OH)_2 (тв) + 2F^- (р-р)\]
Это и есть сокращенное ионное уравнение.
Итак, для записи в тетрадь:
Задача: Написать полное и сокращенное ионные уравнения для реакции:
\(ZnF_2 + NaOH \rightarrow Zn(OH)_2 + NaF\)
Решение:
1. Уравняем молекулярное уравнение:
\(ZnF_2 + 2NaOH \rightarrow Zn(OH)_2 \downarrow + 2NaF\)
(Стрелка вниз \(\downarrow\) указывает на образование осадка)
2. Определим растворимость веществ:
- \(ZnF_2\) (фторид цинка) — малорастворимая соль.
- \(NaOH\) (гидроксид натрия) — сильное основание, растворимо.
- \(Zn(OH)_2\) (гидроксид цинка) — нерастворимое основание (осадок).
- \(NaF\) (фторид натрия) — растворимая соль.
3. Запишем полное ионное уравнение:
Вещества, которые являются сильными электролитами и растворимы в воде, записываем в виде ионов. Нерастворимые вещества записываем в молекулярной форме.
\[ZnF_2 (тв) + 2Na^+ (р-р) + 2OH^- (р-р) \rightarrow Zn(OH)_2 (тв) + 2Na^+ (р-р) + 2F^- (р-р)\]
4. Запишем сокращенное ионное уравнение:
Удаляем "зрительские" ионы (те, которые не участвуют в реакции и остаются в растворе в неизменном виде). В данном случае это ионы \(Na^+\).
\[ZnF_2 (тв) + 2OH^- (р-р) \rightarrow Zn(OH)_2 (тв) + 2F^- (р-р)\]
Ответ:
Полное ионное уравнение:
\[ZnF_2 (тв) + 2Na^+ (р-р) + 2OH^- (р-р) \rightarrow Zn(OH)_2 (тв) + 2Na^+ (р-р) + 2F^- (р-р)\]
Сокращенное ионное уравнение:
\[ZnF_2 (тв) + 2OH^- (р-р) \rightarrow Zn(OH)_2 (тв) + 2F^- (р-р)\]