school
Общие знания
verified
Решено AI
Решение задачи 4: K2SiO3 + HNO3 - Первый вариант
help_outline
Условие задачи
Первый вариант Первый вариант
lightbulb
Краткий ответ
В результате реакции K2SiO3 и HNO3 образуется золь кремниевой кислоты. Для определения формулы мицеллы и коагулирующей способности необходимо учитывать концентрации и заряды ионов электролитов.
Подробное решение
Хорошо, давайте решим задачу 4 для первого варианта.
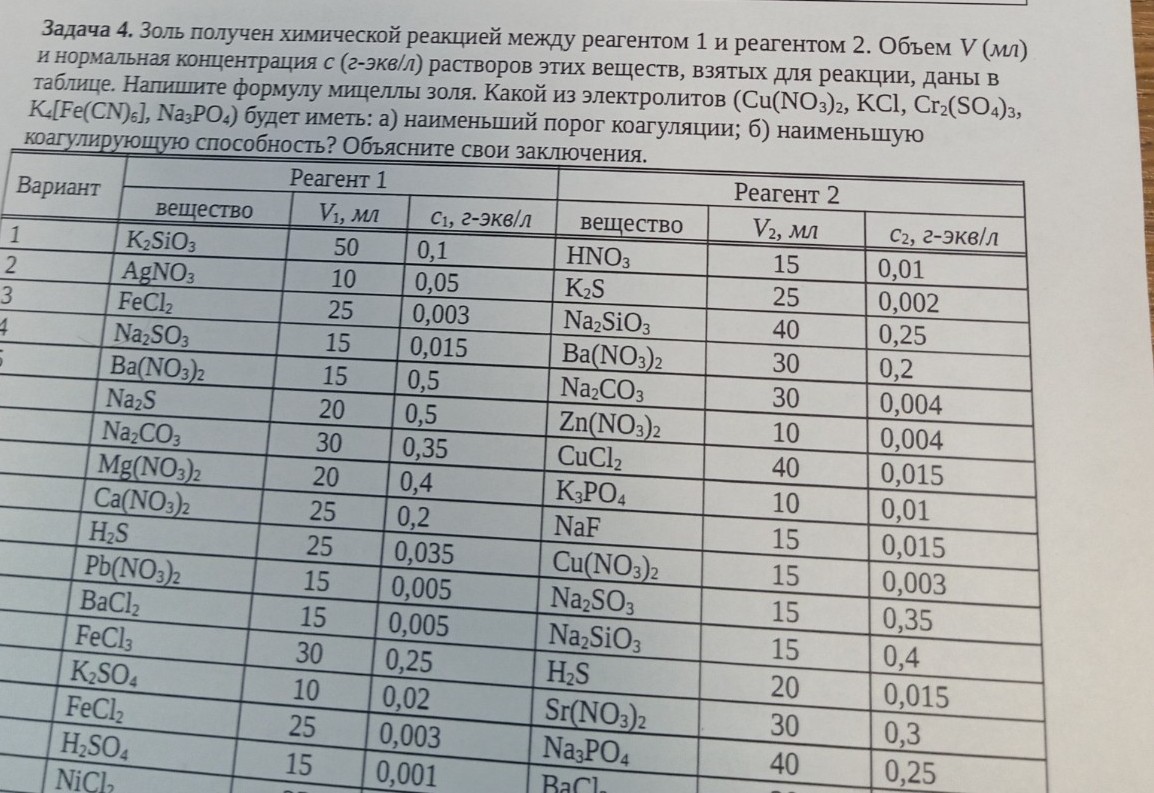
Задача 4. Золь получен химической реакцией между реагентом 1 и реагентом 2. Объем V (мл) и нормальная концентрация с (г-экв/л) растворов этих веществ, взятых для реакции, даны в таблице. Напишите формулу мицеллы золя. Какой из электролитов (\( \text{Cu(NO}_3\text{)}_2 \), \( \text{KCl} \), \( \text{Cr}_2\text{(SO}_4\text{)}_3 \), \( \text{K}_4\text{[Fe(CN)}_6\text{]} \), \( \text{Na}_3\text{PO}_4 \)) будет иметь: а) наименьший порог коагуляции; б) наименьшую коагулирующую способность? Объясните свои заключения.
Для первого варианта:
Реагент 1: \( \text{K}_2\text{SiO}_3 \)
\( V_1 = 50 \) мл
\( C_1 = 0.1 \) г-экв/л
Реагент 2: \( \text{HNO}_3 \)
\( V_2 = 15 \) мл
\( C_2 = 0.01 \) г-экв/л
1. Определение продукта реакции и избытка реагента.
Реакция между силикатом калия и азотной кислотой:
\( \text{K}_2\text{SiO}_3 + 2\text{HNO}_3 \rightarrow \text{H}_2\text{SiO}_3 \downarrow + 2\text{KNO}_3 \)
В результате реакции образуется нерастворимая кремниевая кислота \( \text{H}_2\text{SiO}_3 \), которая является основой золя.
Рассчитаем количество эквивалентов каждого реагента:
Количество эквивалентов \( \text{K}_2\text{SiO}_3 \):
\( N_1 = C_1 \cdot V_1 = 0.1 \text{ г-экв/л} \cdot 0.050 \text{ л} = 0.005 \text{ г-экв} \)
Количество эквивалентов \( \text{HNO}_3 \):
\( N_2 = C_2 \cdot V_2 = 0.01 \text{ г-экв/л} \cdot 0.015 \text{ л} = 0.00015 \text{ г-экв} \)
Сравниваем количества эквивалентов:
\( N_1 = 0.005 \) г-экв
\( N_2 = 0.00015 \) г-экв
Поскольку \( N_1 > N_2 \), \( \text{K}_2\text{SiO}_3 \) находится в избытке. Избыточный реагент определяет заряд гранулы золя.
Избыток \( \text{K}_2\text{SiO}_3 \) диссоциирует на \( \text{2K}^+ \) и \( \text{SiO}_3^{2-} \). Ионы \( \text{SiO}_3^{2-} \) будут адсорбироваться на поверхности частиц \( \text{H}_2\text{SiO}_3 \), придавая им отрицательный заряд.
2. Формула мицеллы золя.
Ядро мицеллы: \( (\text{H}_2\text{SiO}_3)_n \)
Потенциалопределяющие ионы: \( \text{SiO}_3^{2-} \) (из избытка \( \text{K}_2\text{SiO}_3 \))
Противоионы адсорбционного слоя: \( \text{K}^+ \) (из \( \text{K}_2\text{SiO}_3 \))
Противоионы диффузного слоя: \( \text{K}^+ \) (из \( \text{K}_2\text{SiO}_3 \) и \( \text{KNO}_3 \)) и \( \text{NO}_3^- \) (из \( \text{KNO}_3 \))
Формула мицеллы:
\[ \{ (\text{H}_2\text{SiO}_3)_n \cdot m\text{SiO}_3^{2-} \cdot (m-x)\text{K}^+ \}^{x-} \cdot x\text{K}^+ \]
или более подробно:
\[ \{ (\text{H}_2\text{SiO}_3)_n \cdot m\text{SiO}_3^{2-} \cdot (m-x)\text{K}^+ \}^{x-} \cdot x\text{K}^+ \text{ (диффузный слой)} \]
Гранула золя имеет отрицательный заряд.
3. Определение электролитов с наименьшим порогом коагуляции и наименьшей коагулирующей способностью.
Для коагуляции отрицательно заряженного золя необходимы катионы. Чем выше заряд катиона, тем сильнее его коагулирующее действие (правило Шульце-Гарди).
Рассмотрим предложенные электролиты и их катионы:
* \( \text{Cu(NO}_3\text{)}_2 \): \( \text{Cu}^{2+} \) (заряд +2)
* \( \text{KCl} \): \( \text{K}^+ \) (заряд +1)
* \( \text{Cr}_2\text{(SO}_4\text{)}_3 \): \( \text{Cr}^{3+} \) (заряд +3)
* \( \text{K}_4\text{[Fe(CN)}_6\text{]} \): \( \text{K}^+ \) (заряд +1)
* \( \text{Na}_3\text{PO}_4 \): \( \text{Na}^+ \) (заряд +1)
а) Наименьший порог коагуляции.
Порог коагуляции - это минимальная концентрация электролита, вызывающая коагуляцию. Чем выше коагулирующая способность, тем ниже порог коагуляции.
Согласно правилу Шульце-Гарди, коагулирующая способность катионов увеличивается с увеличением их заряда.
Следовательно, наименьший порог коагуляции будет у электролита с катионом, имеющим наибольший заряд.
В нашем случае это \( \text{Cr}^{3+} \) из \( \text{Cr}_2\text{(SO}_4\text{)}_3 \).
б) Наименьшая коагулирующая способность.
Наименьшая коагулирующая способность будет у электролита с катионом, имеющим наименьший заряд.
В нашем случае это \( \text{K}^+ \) (из \( \text{KCl} \) и \( \text{K}_4\text{[Fe(CN)}_6\text{]} \)) и \( \text{Na}^+ \) (из \( \text{Na}_3\text{PO}_4 \)), все они имеют заряд +1.
Среди них, если нет других факторов, их коагулирующая способность будет примерно одинаковой и наименьшей.
Объяснение:
Правило Шульце-Гарди гласит, что коагулирующая способность иона-коагулянта резко возрастает с увеличением его валентности. Для отрицательно заряженного золя коагулянтами являются катионы.
Поэтому:
* Наименьший порог коагуляции (то есть наибольшая коагулирующая способность) будет у \( \text{Cr}_2\text{(SO}_4\text{)}_3 \), так как его катион \( \text{Cr}^{3+} \) имеет заряд +3.
* Наименьшая коагулирующая способность (то есть наибольший порог коагуляции) будет у \( \text{KCl} \), \( \text{K}_4\text{[Fe(CN)}_6\text{]} \) и \( \text{Na}_3\text{PO}_4 \), так как их катионы \( \text{K}^+ \) и \( \text{Na}^+ \) имеют заряд +1.
Ответ:
1. Формула мицеллы золя:
\[ \{ (\text{H}_2\text{SiO}_3)_n \cdot m\text{SiO}_3^{2-} \cdot (m-x)\text{K}^+ \}^{x-} \cdot x\text{K}^+ \]
2. а) Наименьший порог коагуляции будет иметь электролит \( \text{Cr}_2\text{(SO}_4\text{)}_3 \).
б) Наименьшую коагулирующую способность будут иметь электролиты \( \text{KCl} \), \( \text{K}_4\text{[Fe(CN)}_6\text{]} \) и \( \text{Na}_3\text{PO}_4 \).
Объяснение: Согласно правилу Шульце-Гарди, коагулирующая способность иона-коагулянта (в данном случае катиона, так как золь отрицательно заряжен) возрастает с увеличением его валентности. Чем выше коагулирующая способность, тем ниже порог коагуляции. Катион \( \text{Cr}^{3+} \) имеет наибольший заряд (+3), поэтому он обладает наибольшей коагулирующей способностью и, соответственно, наименьшим порогом коагуляции. Катионы \( \text{K}^+ \) и \( \text{Na}^+ \) имеют наименьший заряд (+1), поэтому они обладают наименьшей коагулирующей способностью и, соответственно, наибольшим порогом коагуляции.