schoolМатематика
verifiedРешено AI
Решение задачи по химии: Горение магния
help_outlineУсловие задачи
по химии
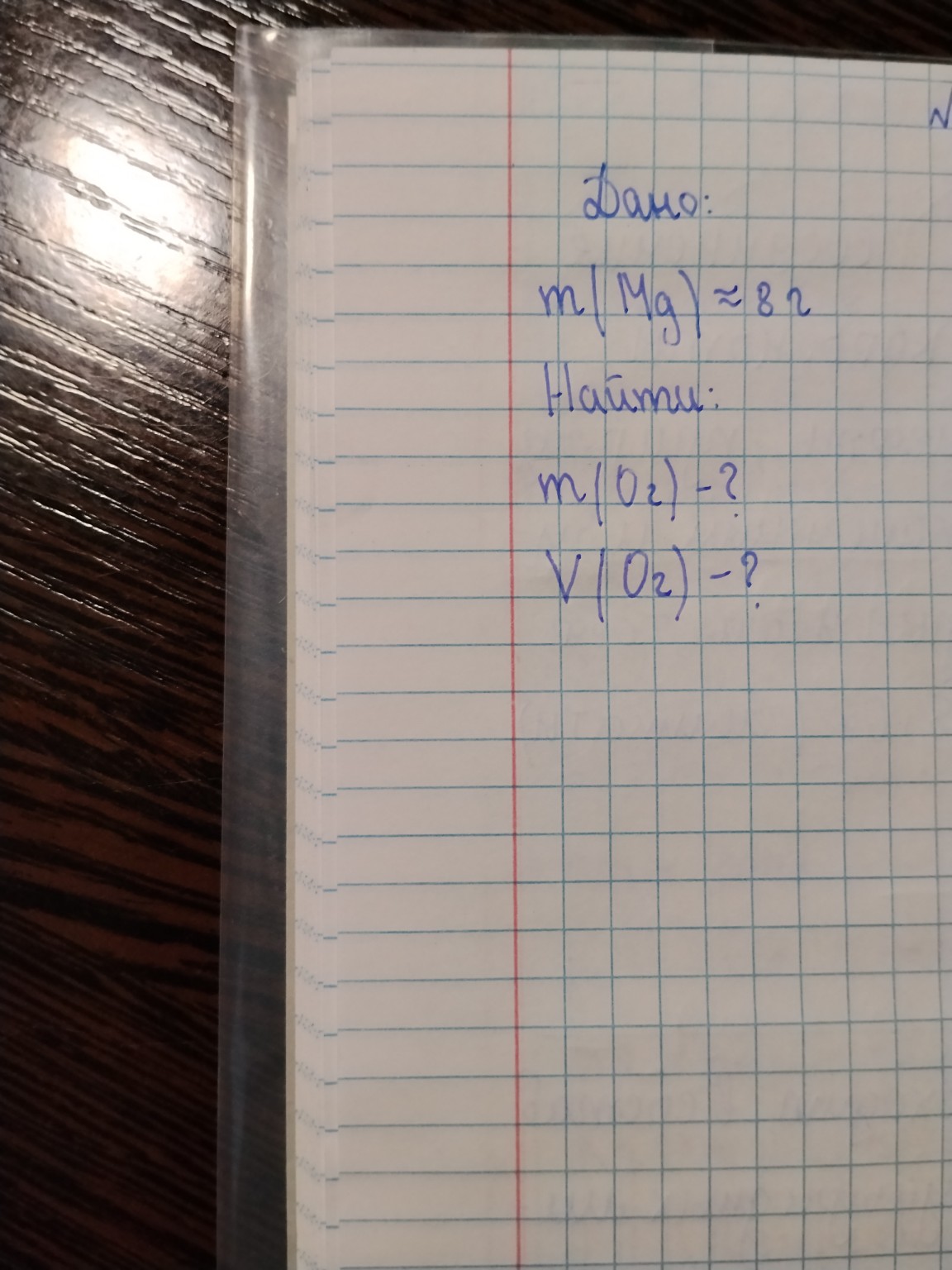
lightbulbКраткий ответ
Для сжигания 8 г магния требуется примерно 5.34 г кислорода, что соответствует объему около 3.74 литров (при нормальных условиях). Задача решена с использованием уравнения реакции и расчетов молярных масс.
Подробное решение
Дано:
\(m(Mg) = 8\) г
Найти:
\(m(O_{2}) - ?\)
\(V(O_{2}) - ?\)
Решение:
1. Составим уравнение реакции горения магния:
\[2Mg + O_{2} \rightarrow 2MgO\]
2. Рассчитаем количество вещества магния, используя его молярную массу \(M(Mg) = 24\) г/моль:
\[n(Mg) = \frac{m(Mg)}{M(Mg)} = \frac{8 \text{ г}}{24 \text{ г/моль}} \approx 0,333 \text{ моль}\]
3. По уравнению реакции видно, что на 2 моль магния требуется 1 моль кислорода. Следовательно, количество вещества кислорода в 2 раза меньше:
\[n(O_{2}) = \frac{1}{2} n(Mg) = \frac{0,333}{2} \approx 0,167 \text{ моль}\]
4. Вычислим массу кислорода, используя его молярную массу \(M(O_{2}) = 32\) г/моль:
\[m(O_{2}) = n(O_{2}) \cdot M(O_{2}) = 0,167 \text{ моль} \cdot 32 \text{ г/моль} \approx 5,34 \text{ г}\]
5. Вычислим объем кислорода при нормальных условиях (н.у.), используя молярный объем газа \(V_{m} = 22,4\) л/моль:
\[V(O_{2}) = n(O_{2}) \cdot V_{m} = 0,167 \text{ моль} \cdot 22,4 \text{ л/моль} \approx 3,74 \text{ л}\]
Ответ: \(m(O_{2}) \approx 5,34\) г; \(V(O_{2}) \approx 3,74\) л.