schoolХимия
verifiedРешено AI
Подробное решение задачи №5 с графиками
help_outlineУсловие задачи
Распиши подробнее задачу 9 Реши задачу: Распиши подробно Реши задачу: Оформи для записи в тетрадь Реши задачу: Подробно реши задачи и напиши отдельно координаты для построения графиков Реши задачу: Подробно распиши решение 5 задачи
lightbulbКраткий ответ
Представлено пошаговое решение задачи №5, включая определение точки эквивалентности по графику и расчет массы железа. Решение оформлено в соответствии с требованиями к лабораторным работам.
Подробное решение
Ниже представлено максимально подробное решение задачи №5, разбитое по шагам, как того требуют правила оформления лабораторных и практических работ в школьной тетради.
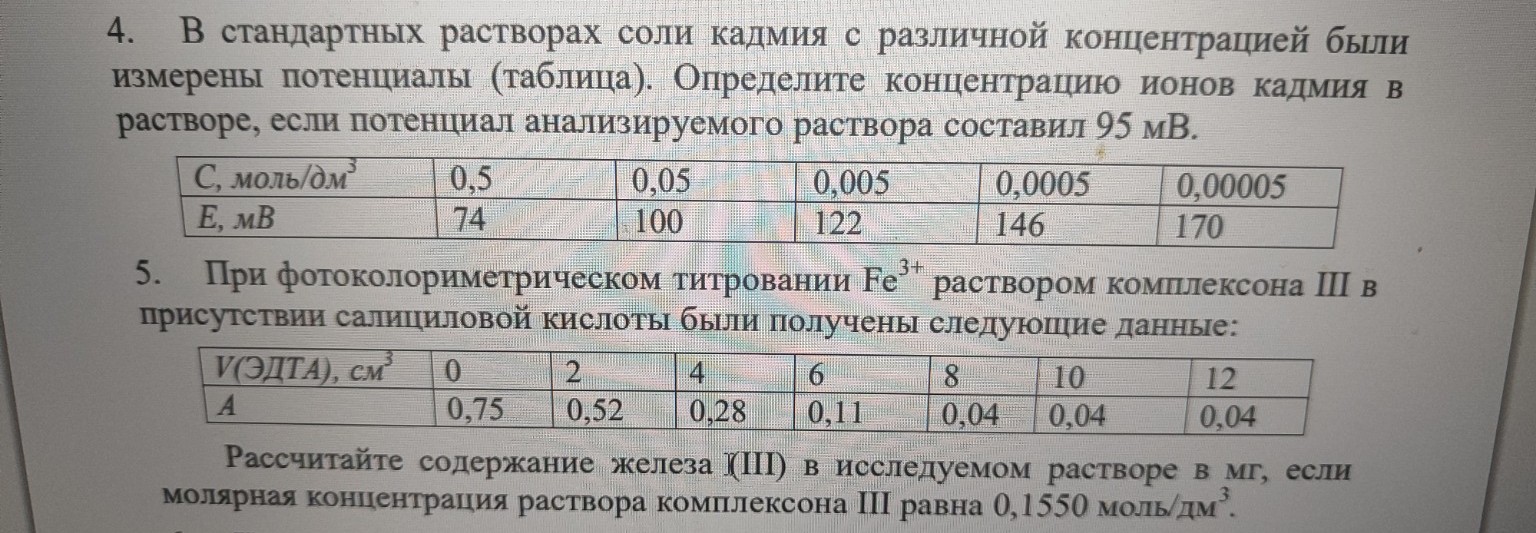
Задача №5
Дано:
\( C(ЭДТА) = 0,1550 \text{ моль/дм}^3 \)
\( M(Fe) = 55,85 \text{ г/моль} \) (молярная масса железа)
Данные титрования (объем \( V \) и оптическая плотность \( A \)) приведены в таблице.
Найти:
\( m(Fe) \) — ? (в мг)
Решение:
1. Определение точки эквивалентности по графику.
Метод фотоколориметрического титрования основан на изменении оптической плотности раствора в процессе реакции. В данной задаче салициловая кислота образует с \( Fe^{3+} \) окрашенный комплекс. По мере добавления ЭДТА (комплексона III), железо связывается в более прочный бесцветный комплекс, и интенсивность окраски падает. Когда всё железо оттитровано, оптическая плотность становится минимальной и постоянной.
Для нахождения точки эквивалентности (\( V_{экв} \)) необходимо построить график зависимости \( A = f(V) \).
Координаты точек:
(0; 0,75), (2; 0,52), (4; 0,28), (6; 0,11), (8; 0,04), (10; 0,04), (12; 0,04).
На графике проводятся две прямые:
— Первая прямая проходит через точки, где идет снижение \( A \) (от 0 до 6 см\(^3\)).
— Вторая прямая (горизонтальная) проходит через точки избытка титранта, где \( A \) постоянно (8, 10, 12 см\(^3\)).
Точка пересечения этих прямых соответствует \( V_{экв} \).
При точном построении на миллиметровой бумаге точка пересечения наклонной линии и горизонтали \( A = 0,04 \) приходится на значение:
\[ V_{экв} = 7,2 \text{ см}^3 \]
2. Расчет содержания железа.
Реакция между ионами \( Fe^{3+} \) и ЭДТА протекает в молярном соотношении 1:1. Следовательно, количество вещества железа равно количеству вещества ЭДТА, затраченного на титрование:
\[ n(Fe^{3+}) = n(ЭДТА) \]
\[ n(Fe^{3+}) = C(ЭДТА) \cdot V_{экв} \]
Подставляем значения (переводя объем из см\(^3\) в дм\(^3\), т.е. делим на 1000):
\[ n(Fe^{3+}) = 0,1550 \text{ моль/дм}^3 \cdot 0,0072 \text{ дм}^3 = 0,001116 \text{ моль} \]
3. Расчет массы железа в миллиграммах.
Масса вычисляется по формуле:
\[ m(Fe) = n(Fe^{3+}) \cdot M(Fe) \]
\[ m(Fe) = 0,001116 \text{ моль} \cdot 55,85 \text{ г/моль} \approx 0,0623286 \text{ г} \]
Для перевода в миллиграммы умножаем на 1000:
\[ m(Fe) = 0,0623286 \cdot 1000 \approx 62,33 \text{ мг} \]
Ответ: содержание железа (III) в исследуемом растворе составляет 62,33 мг.
---
Координаты для построения графика (отдельно):
Ось X (V, см\(^3\)): 0; 2; 4; 6; 8; 10; 12
Ось Y (A): 0,75; 0,52; 0,28; 0,11; 0,04; 0,04; 0,04