schoolМатематика
verifiedРешено AI
Решение задач №4 и №5: Градуировочный график и расчет концентрации
help_outlineУсловие задачи
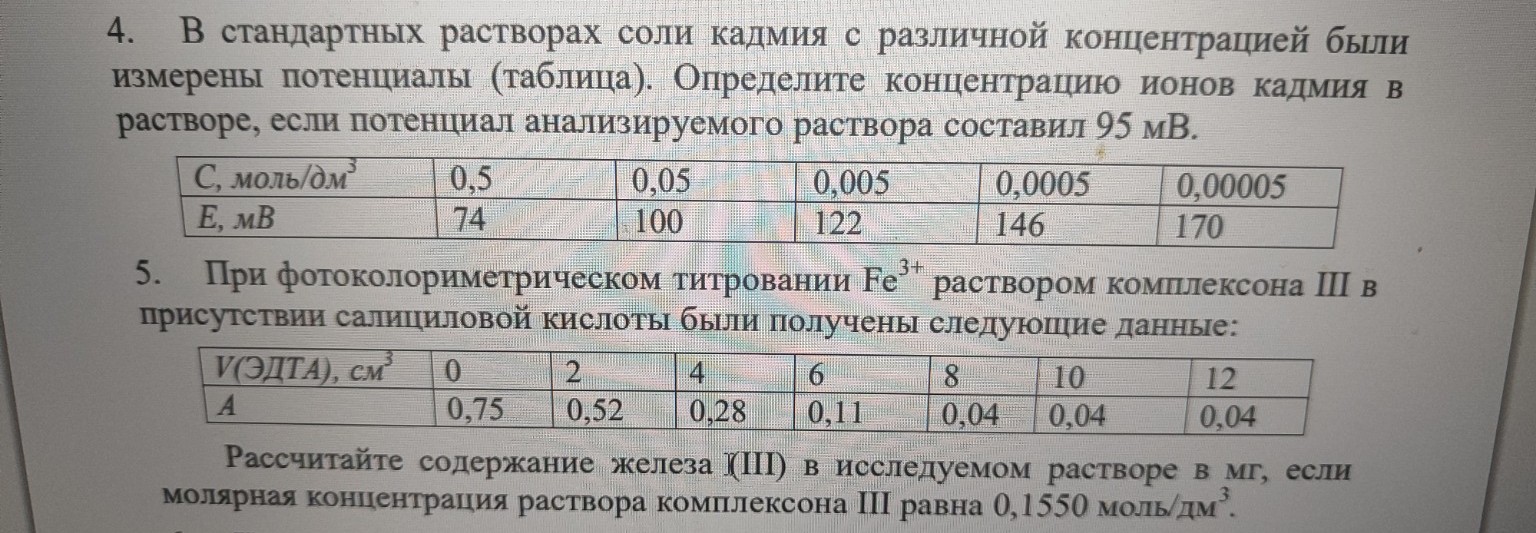
Распиши задачу 8 Реши задачу: Распиши подробнее задачу 9 Реши задачу: Распиши подробно Реши задачу: Оформи для записи в тетрадь Реши задачу: Подробно реши задачи и напиши отдельно координаты для построения графиков
lightbulbКраткий ответ
Представлено подробное решение задач №4 и №5 с использованием градуировочного графика. Включает расчет концентрации ионов кадмия и таблицы с координатами для построения графиков.
Подробное решение
Ниже представлено подробное решение задач №4 и №5 для записи в тетрадь, а также таблицы с координатами для построения графиков.
Задача №4
Решение:
Для определения концентрации ионов кадмия используется метод градуировочного графика в прямой потенциометрии. Согласно уравнению Нернста, потенциал электрода (\( E \)) линейно зависит от десятичного логарифма концентрации (\( -\lg C \)).
1. Подготовим данные для построения графика. Рассчитаем значения \( pC = -\lg C \) для каждого стандартного раствора:
— Для \( C = 0,5 \): \( pC = -\lg(0,5) \approx 0,30 \)
— Для \( C = 0,05 \): \( pC = -\lg(0,05) \approx 1,30 \)
— Для \( C = 0,005 \): \( pC = -\lg(0,005) \approx 2,30 \)
— Для \( C = 0,0005 \): \( pC = -\lg(0,0005) \approx 3,30 \)
— Для \( C = 0,00005 \): \( pC = -\lg(0,00005) \approx 4,30 \)
Координаты для графика (ось X: \( pC \), ось Y: \( E, \text{ мВ} \)):
(0,30; 74), (1,30; 100), (2,30; 122), (3,30; 146), (4,30; 170).
2. Построив прямую по этим точкам, находим на оси Y значение потенциала анализируемого раствора \( E_x = 95 \text{ мВ} \).
3. Проводим горизонтальную линию от \( E = 95 \) до пересечения с графиком, затем опускаем перпендикуляр на ось X.
4. Из графика (или путем линейной интерполяции между первыми двумя точками) находим значение \( pC_x \):
Между 74 мВ (\( pC=0,3 \)) и 100 мВ (\( pC=1,3 \)) разница составляет 26 мВ на 1 единицу \( pC \).
Для 95 мВ:
\[ pC_x = 0,3 + \frac{95 - 74}{100 - 74} \cdot (1,3 - 0,3) = 0,3 + \frac{21}{26} \cdot 1 \approx 1,11 \]
5. Вычисляем концентрацию:
\[ C_x = 10^{-pC_x} = 10^{-1,11} \approx 0,0776 \text{ моль/дм}^3 \]
Ответ: \( C(Cd^{2+}) \approx 0,0776 \text{ моль/дм}^3 \).
---
Задача №5
Решение:
Содержание железа определяется по точке эквивалентности на кривой фотоколориметрического титрования.
1. Построим график зависимости оптической плотности (\( A \)) от объема титранта (\( V \)).
Координаты для графика (ось X: \( V, \text{ см}^3 \), ось Y: \( A \)):
(0; 0,75), (2; 0,52), (4; 0,28), (6; 0,11), (8; 0,04), (10; 0,04), (12; 0,04).
2. Точка эквивалентности (\( V_{экв} \)) находится как точка пересечения двух прямых: падающей линии титрования и горизонтальной линии избытка титранта.
Из графика видно, что после \( V = 8 \text{ см}^3 \) оптическая плотность перестает меняться. Точка пересечения наклонной линии (через первые 4 точки) и прямой \( A = 0,04 \) дает:
\[ V_{экв} \approx 7,2 \text{ см}^3 \]
3. Рассчитаем массу железа. Реакция идет в соотношении 1:1.
Формула: \( m(Fe) = C(ЭДТА) \cdot V_{экв} \cdot M(Fe) \), где \( M(Fe) = 55,85 \text{ г/моль} \).
Переведем объем в дм\(^3\): \( 7,2 \text{ см}^3 = 0,0072 \text{ дм}^3 \).
\[ m(Fe) = 0,1550 \cdot 0,0072 \cdot 55,85 \approx 0,0623 \text{ г} \]
Переведем в мг:
\[ m(Fe) = 62,3 \text{ мг} \]
Ответ: содержание железа (III) составляет \( 62,3 \text{ мг} \).
---
Координаты для построения графиков (вынести отдельно):
Для графика №4 (Потенциометрия):
Ось X (\( pC \)): 0,30 | 1,30 | 2,30 | 3,30 | 4,30
Ось Y (\( E, \text{ мВ} \)): 74 | 100 | 122 | 146 | 170
Для графика №5 (Титрование):
Ось X (\( V, \text{ см}^3 \)): 0 | 2 | 4 | 6 | 8 | 10 | 12
Ось Y (\( A \)): 0,75 | 0,52 | 0,28 | 0,11 | 0,04 | 0,04 | 0,04