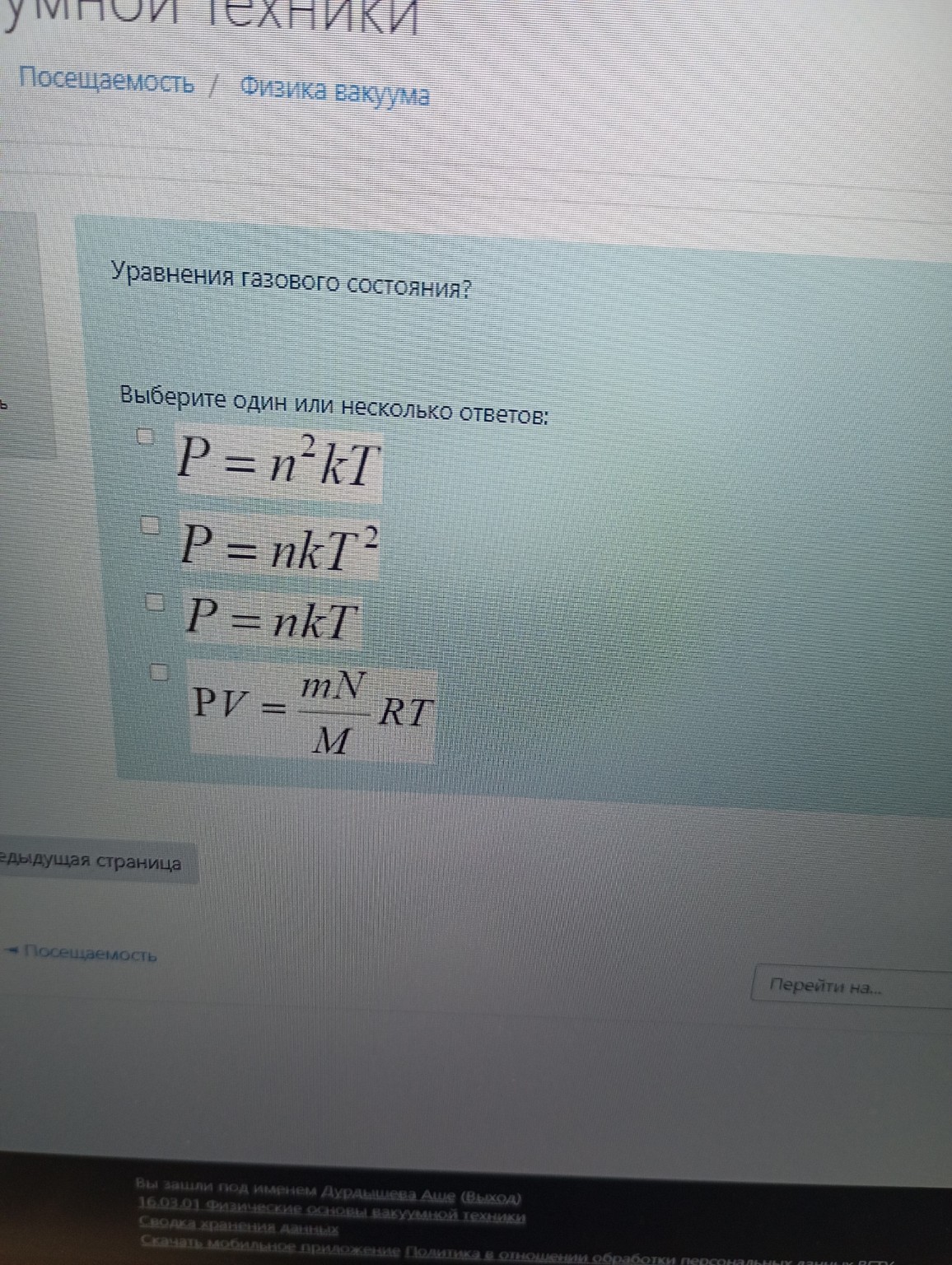
Задача: Уравнения газового состояния?
Выберите один или несколько ответов:
- \(P = n^2kT\)
- \(P = nkT^2\)
- \(P = nkT\)
- \(PV = \frac{mN}{M}RT\)
Решение:
Для решения этой задачи необходимо вспомнить основные уравнения, описывающие состояние идеального газа.
1. Уравнение Менделеева-Клапейрона:
Это одно из фундаментальных уравнений, описывающих состояние идеального газа. Оно связывает давление, объем, количество вещества и температуру газа.
Формула выглядит так:
\[PV = \nu RT\]Где:
- \(P\) – давление газа
- \(V\) – объем газа
- \(\nu\) – количество вещества (число молей)
- \(R\) – универсальная газовая постоянная
- \(T\) – абсолютная температура газа
Количество вещества \(\nu\) можно выразить как отношение массы газа \(m\) к его молярной массе \(M\):
\[\nu = \frac{m}{M}\]Подставляя это выражение в уравнение Менделеева-Клапейрона, получаем:
\[PV = \frac{m}{M}RT\]Сравнивая это с вариантами ответов, мы видим, что вариант 4 очень похож, но содержит \(N\) вместо \(m\). Однако, если \(N\) здесь обозначает число молекул, то это не совсем корректно в таком виде. Если же \(N\) – это число молей, то это просто другое обозначение для \(\nu\). Но в данном случае, скорее всего, имелось в виду, что \(N\) – это число молекул, а \(m\) – это масса одной молекулы. Тогда \(mN\) – это общая масса газа. В таком случае, вариант 4: \(PV = \frac{mN}{M}RT\) является корректным, если \(mN\) обозначает общую массу газа, а \(M\) – молярную массу.
2. Уравнение состояния идеального газа в молекулярно-кинетической теории (уравнение Клапейрона-Больцмана):
Это уравнение связывает давление газа с концентрацией молекул и температурой.
Формула выглядит так:
\[P = nkT\]Где:
- \(P\) – давление газа
- \(n\) – концентрация молекул (число молекул в единице объема)
- \(k\) – постоянная Больцмана
- \(T\) – абсолютная температура газа
Сравнивая это с вариантами ответов, мы видим, что вариант 3: \(P = nkT\) является точным совпадением.
Анализ предложенных вариантов:
- \(P = n^2kT\) – Не является стандартным уравнением газового состояния. Концентрация \(n\) не возводится в квадрат.
- \(P = nkT^2\) – Не является стандартным уравнением газового состояния. Температура \(T\) не возводится в квадрат.
- \(P = nkT\) – Это уравнение состояния идеального газа, выраженное через концентрацию молекул и постоянную Больцмана. Это правильный ответ.
- \(PV = \frac{mN}{M}RT\) – Это уравнение Менделеева-Клапейрона, если \(mN\) интерпретировать как общую массу газа, а \(M\) как молярную массу. В таком случае, это также правильный ответ.
Вывод:
Правильными уравнениями газового состояния из предложенных являются:
3. \(P = nkT\)
4. \(PV = \frac{mN}{M}RT\)