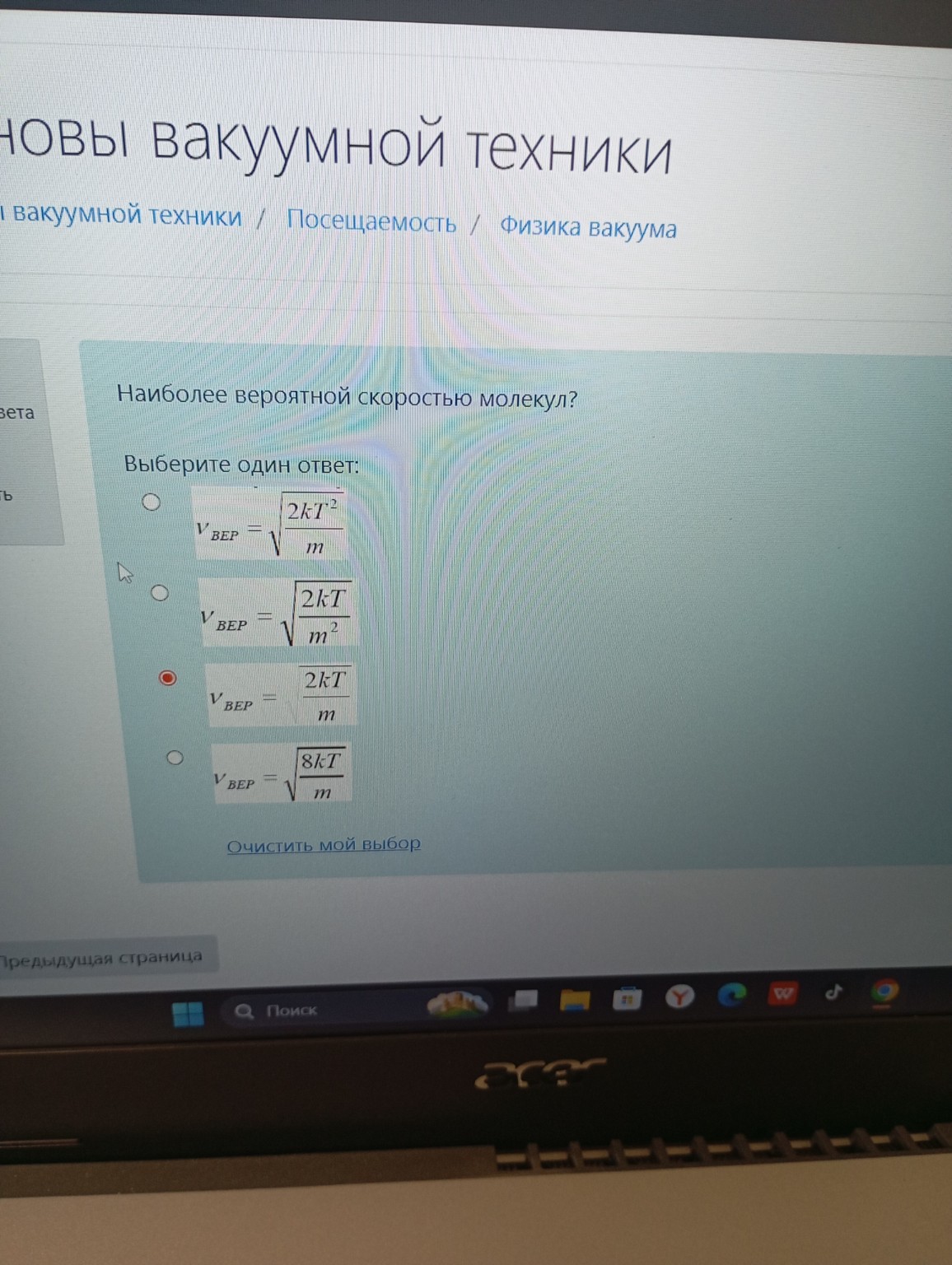
Задача: Наиболее вероятной скоростью молекул?
Выберите один ответ:
- \(V_{ВЕР} = \sqrt{\frac{2kT^2}{m}}\)
- \(V_{ВЕР} = \sqrt{\frac{2kT}{m^2}}\)
- \(V_{ВЕР} = \sqrt{\frac{2kT}{m}}\)
- \(V_{ВЕР} = \sqrt{\frac{8kT}{m}}\)
Решение:
В молекулярно-кинетической теории газов различают несколько характеристических скоростей молекул: наиболее вероятную скорость, среднюю арифметическую скорость и среднеквадратичную скорость. Все они выводятся из распределения Максвелла по скоростям.
Наиболее вероятная скорость (\(V_{ВЕР}\)) — это скорость, которой обладает наибольшее число молекул газа при данной температуре. Она соответствует максимуму функции распределения Максвелла.
Формула для наиболее вероятной скорости молекул газа имеет вид:
\[V_{ВЕР} = \sqrt{\frac{2kT}{m}}\]Где:
- \(k\) – постоянная Больцмана (\(1.38 \times 10^{-23}\) Дж/К)
- \(T\) – абсолютная температура газа (в Кельвинах)
- \(m\) – масса одной молекулы газа (в килограммах)
Теперь проанализируем предложенные варианты ответов:
1. \(V_{ВЕР} = \sqrt{\frac{2kT^2}{m}}\)
В этой формуле температура \(T\) возведена в квадрат, что не соответствует стандартной формуле для наиболее вероятной скорости.
2. \(V_{ВЕР} = \sqrt{\frac{2kT}{m^2}}\)
В этой формуле масса молекулы \(m\) возведена в квадрат, что также не соответствует стандартной формуле.
3. \(V_{ВЕР} = \sqrt{\frac{2kT}{m}}\)
Эта формула точно соответствует стандартному выражению для наиболее вероятной скорости молекул газа.
4. \(V_{ВЕР} = \sqrt{\frac{8kT}{m}}\)
Эта формула похожа на формулу для средней арифметической скорости, которая равна \(V_{СР} = \sqrt{\frac{8kT}{\pi m}}\). Предложенный вариант отличается от нее отсутствием \(\pi\) в знаменателе, и не является формулой для наиболее вероятной скорости.
Вывод:
Единственный вариант, который правильно описывает наиболее вероятную скорость молекул, это вариант 3.
Правильный ответ:
3. \(V_{ВЕР} = \sqrt{\frac{2kT}{m}}\)