school
Общие знания
verified
Решено AI
Решение ОВР: FeCl3 + H2S = S + FeCl2 + HCl
help_outline
Условие задачи
Реши овр
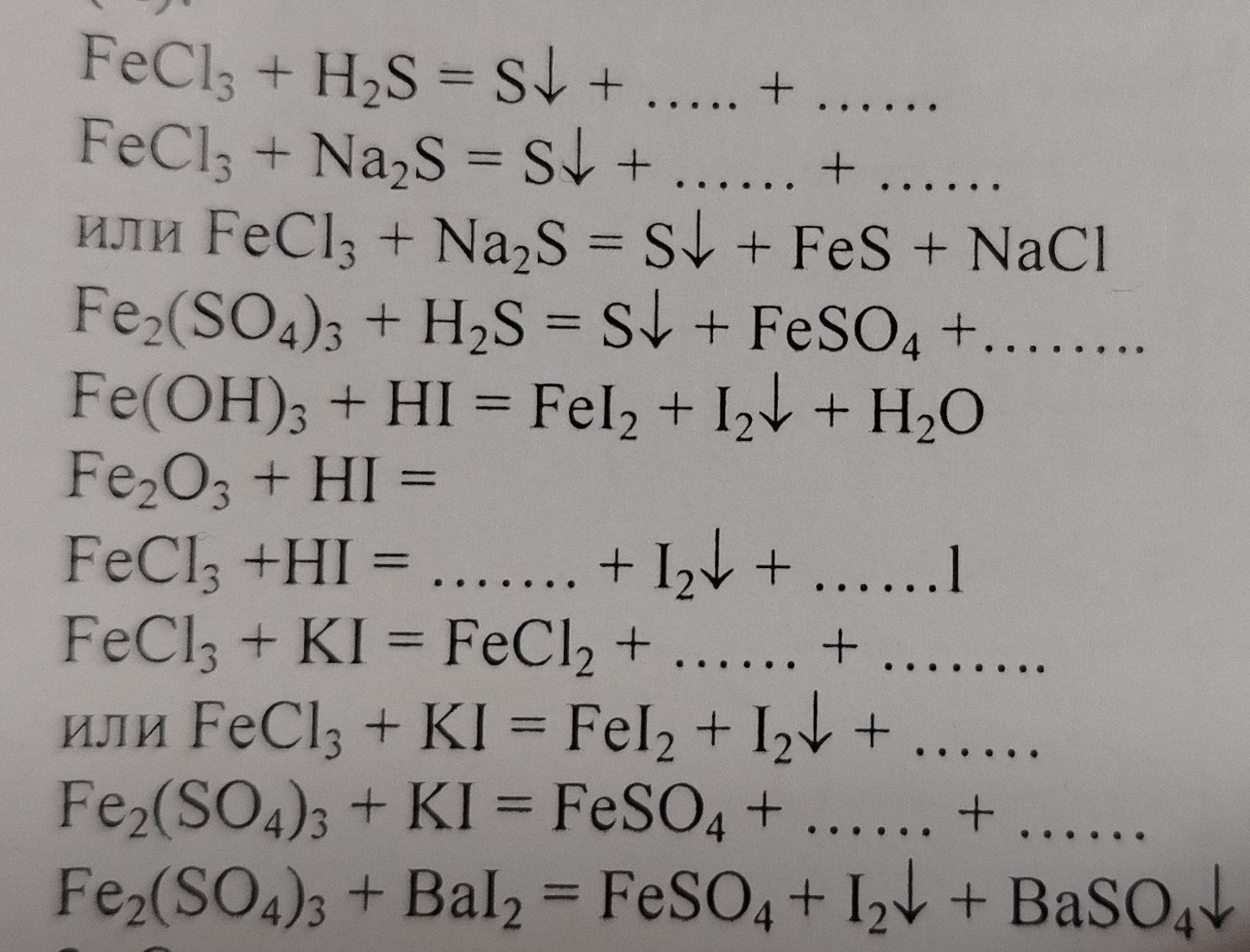
lightbulb
Краткий ответ
В реакции FeCl3 + H2S, FeCl3 является окислителем, а H2S - восстановителем. В результате реакции образуется сера, хлорид железа (II) и соляная кислота.
Подробное решение
Хорошо, давайте решим эти окислительно-восстановительные реакции (ОВР).
1. \[ \text{FeCl}_3 + \text{H}_2\text{S} = \text{S}\downarrow + \text{FeCl}_2 + \text{HCl} \]
* Окислитель: \( \text{Fe}^{3+} \) (в \( \text{FeCl}_3 \)) принимает электрон, восстанавливается до \( \text{Fe}^{2+} \) (в \( \text{FeCl}_2 \)).
* Восстановитель: \( \text{S}^{2-} \) (в \( \text{H}_2\text{S} \)) отдает электроны, окисляется до \( \text{S}^0 \) (в \( \text{S}\downarrow \)).
* Уравнение электронного баланса:
* \( \text{Fe}^{3+} + 1\text{e}^- \rightarrow \text{Fe}^{2+} \)
* \( \text{S}^{2-} - 2\text{e}^- \rightarrow \text{S}^0 \)
* Коэффициенты: \( 2\text{Fe}^{3+} \) и \( 1\text{S}^{2-} \).
* Расставляем коэффициенты в уравнении:
\[ 2\text{FeCl}_3 + \text{H}_2\text{S} = \text{S}\downarrow + 2\text{FeCl}_2 + 2\text{HCl} \]
2. \[ \text{FeCl}_3 + \text{Na}_2\text{S} = \text{S}\downarrow + \text{FeCl}_2 + \text{NaCl} \]
* Окислитель: \( \text{Fe}^{3+} \) (в \( \text{FeCl}_3 \)) принимает электрон, восстанавливается до \( \text{Fe}^{2+} \) (в \( \text{FeCl}_2 \)).
* Восстановитель: \( \text{S}^{2-} \) (в \( \text{Na}_2\text{S} \)) отдает электроны, окисляется до \( \text{S}^0 \) (в \( \text{S}\downarrow \)).
* Уравнение электронного баланса:
* \( \text{Fe}^{3+} + 1\text{e}^- \rightarrow \text{Fe}^{2+} \)
* \( \text{S}^{2-} - 2\text{e}^- \rightarrow \text{S}^0 \)
* Коэффициенты: \( 2\text{Fe}^{3+} \) и \( 1\text{S}^{2-} \).
* Расставляем коэффициенты в уравнении:
\[ 2\text{FeCl}_3 + \text{Na}_2\text{S} = \text{S}\downarrow + 2\text{FeCl}_2 + 2\text{NaCl} \]
3. \[ \text{или } \text{FeCl}_3 + \text{Na}_2\text{S} = \text{S}\downarrow + \text{FeS} + \text{NaCl} \]
* В этом случае, часть \( \text{Fe}^{3+} \) восстанавливается до \( \text{Fe}^{2+} \) и образует нерастворимый сульфид железа(II).
* Окислитель: \( \text{Fe}^{3+} \) (в \( \text{FeCl}_3 \)) принимает электрон, восстанавливается до \( \text{Fe}^{2+} \) (в \( \text{FeS} \)).
* Восстановитель: \( \text{S}^{2-} \) (в \( \text{Na}_2\text{S} \)) отдает электроны, окисляется до \( \text{S}^0 \) (в \( \text{S}\downarrow \)).
* Уравнение электронного баланса:
* \( \text{Fe}^{3+} + 1\text{e}^- \rightarrow \text{Fe}^{2+} \)
* \( \text{S}^{2-} - 2\text{e}^- \rightarrow \text{S}^0 \)
* Коэффициенты: \( 2\text{Fe}^{3+} \) и \( 1\text{S}^{2-} \).
* Расставляем коэффициенты в уравнении:
\[ 2\text{FeCl}_3 + 3\text{Na}_2\text{S} = \text{S}\downarrow + 2\text{FeS}\downarrow + 6\text{NaCl} \]
(Здесь нужно учесть, что часть сульфид-ионов идет на образование \( \text{FeS} \), а часть на окисление до серы. Поэтому коэффициенты будут другими.)
Давайте пересчитаем:
* \( \text{Fe}^{3+} + 1\text{e}^- \rightarrow \text{Fe}^{2+} \) (для \( \text{FeS} \))
* \( \text{S}^{2-} - 2\text{e}^- \rightarrow \text{S}^0 \) (для \( \text{S}\downarrow \))
* Чтобы уравнять электроны, нужно 2 атома \( \text{Fe}^{3+} \) и 1 ион \( \text{S}^{2-} \).
* Но у нас еще есть \( \text{FeS} \), где \( \text{Fe} \) тоже \( +2 \).
* Рассмотрим, что \( \text{Fe}^{3+} \) восстанавливается до \( \text{Fe}^{2+} \).
* Пусть \( x \) моль \( \text{FeCl}_3 \) восстанавливается до \( \text{FeS} \), и \( y \) моль \( \text{FeCl}_3 \) восстанавливается до \( \text{FeCl}_2 \) (если бы был такой вариант).
* В данном случае, все \( \text{Fe}^{3+} \) восстанавливается до \( \text{Fe}^{2+} \), но часть серы окисляется, а часть остается в степени окисления \( -2 \).
* Пусть \( \text{FeCl}_3 \) - окислитель, \( \text{Na}_2\text{S} \) - восстановитель.
* \( \text{Fe}^{3+} + 1\text{e}^- \rightarrow \text{Fe}^{2+} \)
* \( \text{S}^{2-} - 2\text{e}^- \rightarrow \text{S}^0 \)
* Для реакции: \( 2\text{FeCl}_3 + 3\text{Na}_2\text{S} = 2\text{FeS}\downarrow + \text{S}\downarrow + 6\text{NaCl} \)
* Здесь 2 атома \( \text{Fe}^{3+} \) принимают по 1 электрону, всего 2 электрона.
* 1 атом \( \text{S}^{2-} \) отдает 2 электрона.
* Остальные 2 атома \( \text{S}^{2-} \) идут на образование \( \text{FeS} \).
* Баланс по \( \text{Fe} \): 2 слева, 2 справа.
* Баланс по \( \text{S} \): 3 слева, 2 в \( \text{FeS} \) и 1 в \( \text{S} \), всего 3 справа.
* Баланс по \( \text{Na} \): 6 слева, 6 справа.
* Баланс по \( \text{Cl} \): 6 слева, 6 справа.
* Это уравнение верно.
4. \[ \text{Fe}_2(\text{SO}_4)_3 + \text{H}_2\text{S} = \text{S}\downarrow + \text{FeSO}_4 + \text{H}_2\text{SO}_4 \]
* Окислитель: \( \text{Fe}^{3+} \) (в \( \text{Fe}_2(\text{SO}_4)_3 \)) принимает электрон, восстанавливается до \( \text{Fe}^{2+} \) (в \( \text{FeSO}_4 \)).
* Восстановитель: \( \text{S}^{2-} \) (в \( \text{H}_2\text{S} \)) отдает электроны, окисляется до \( \text{S}^0 \) (в \( \text{S}\downarrow \)).
* Уравнение электронного баланса:
* \( \text{Fe}^{3+} + 1\text{e}^- \rightarrow \text{Fe}^{2+} \)
* \( \text{S}^{2-} - 2\text{e}^- \rightarrow \text{S}^0 \)
* Коэффициенты: \( 2\text{Fe}^{3+} \) и \( 1\text{S}^{2-} \).
* Расставляем коэффициенты в уравнении:
\[ \text{Fe}_2(\text{SO}_4)_3 + \text{H}_2\text{S} = \text{S}\downarrow + 2\text{FeSO}_4 + \text{H}_2\text{SO}_4 \]
5. \[ \text{Fe}(\text{OH})_3 + \text{HI} = \text{FeI}_2 + \text{I}_2\downarrow + \text{H}_2\text{O} \]
* Окислитель: \( \text{Fe}^{3+} \) (в \( \text{Fe}(\text{OH})_3 \)) принимает электрон, восстанавливается до \( \text{Fe}^{2+} \) (в \( \text{FeI}_2 \)).
* Восстановитель: \( \text{I}^- \) (в \( \text{HI} \)) отдает электроны, окисляется до \( \text{I}_2^0 \) (в \( \text{I}_2\downarrow \)).
* Уравнение электронного баланса:
* \( \text{Fe}^{3+} + 1\text{e}^- \rightarrow \text{Fe}^{2+} \)
* \( 2\text{I}^- - 2\text{e}^- \rightarrow \text{I}_2^0 \)
* Коэффициенты: \( 2\text{Fe}^{3+} \) и \( 1\text{I}_2^0 \) (т.е. 2 \( \text{I}^- \)).
* Расставляем коэффициенты в уравнении:
\[ 2\text{Fe}(\text{OH})_3 + 8\text{HI} = 2\text{FeI}_2 + \text{I}_2\downarrow + 6\text{H}_2\text{O} \]
(Здесь 2 атома \( \text{Fe} \) восстанавливаются, для этого нужно 2 электрона. Эти 2 электрона отдают 2 иона \( \text{I}^- \), образуя 1 молекулу \( \text{I}_2 \). Остальные ионы \( \text{I}^- \) идут на образование \( \text{FeI}_2 \) и \( \text{H}_2\text{O} \).)
Давайте проверим:
* \( \text{Fe}: 2 \) слева, \( 2 \) справа.
* \( \text{O}: 2 \times 3 = 6 \) слева, \( 6 \) справа.
* \( \text{H}: 2 \times 3 + 8 = 14 \) слева, \( 6 \times 2 = 12 \) в \( \text{H}_2\text{O} \) и \( 0 \) в \( \text{FeI}_2 \) и \( \text{I}_2 \). Не сходится.
* Пересчитаем \( \text{HI} \). Для \( 2\text{FeI}_2 \) нужно \( 4\text{I}^- \). Для \( \text{I}_2 \) нужно \( 2\text{I}^- \). Всего \( 6\text{I}^- \).
* Значит, \( 6\text{HI} \).
* \( 2\text{Fe}(\text{OH})_3 + 6\text{HI} = 2\text{FeI}_2 + \text{I}_2\downarrow + 6\text{H}_2\text{O} \)
* Проверим \( \text{H} \): \( 2 \times 3 + 6 = 12 \) слева. \( 6 \times 2 = 12 \) справа. Теперь сходится.
6. \[ \text{Fe}_2\text{O}_3 + \text{HI} = \text{FeI}_2 + \text{I}_2\downarrow + \text{H}_2\text{O} \]
* Окислитель: \( \text{Fe}^{3+} \) (в \( \text{Fe}_2\text{O}_3 \)) принимает электрон, восстанавливается до \( \text{Fe}^{2+} \) (в \( \text{FeI}_2 \)).
* Восстановитель: \( \text{I}^- \) (в \( \text{HI} \)) отдает электроны, окисляется до \( \text{I}_2^0 \) (в \( \text{I}_2\downarrow \)).
* Уравнение электронного баланса:
* \( \text{Fe}^{3+} + 1\text{e}^- \rightarrow \text{Fe}^{2+} \)
* \( 2\text{I}^- - 2\text{e}^- \rightarrow \text{I}_2^0 \)
* Коэффициенты: \( 2\text{Fe}^{3+} \) и \( 1\text{I}_2^0 \) (т.е. 2 \( \text{I}^- \)).
* Расставляем коэффициенты в уравнении:
\[ \text{Fe}_2\text{O}_3 + 8\text{HI} = 2\text{FeI}_2 + \text{I}_2\downarrow + 4\text{H}_2\text{O} \]
* Проверим:
* \( \text{Fe}: 2 \) слева, \( 2 \) справа.
* \( \text{O}: 3 \) слева, \( 4 \) справа. Не сходится.
* Давайте пересчитаем \( \text{H}_2\text{O} \).
* Для \( 2\text{FeI}_2 \) нужно \( 4\text{I}^- \). Для \( \text{I}_2 \) нужно \( 2\text{I}^- \). Всего \( 6\text{I}^- \).
* Значит, \( 6\text{HI} \).
* \( \text{Fe}_2\text{O}_3 + 6\text{HI} = 2\text{FeI}_2 + \text{I}_2\downarrow + 3\text{H}_2\text{O} \)
* Проверим:
* \( \text{Fe}: 2 \) слева, \( 2 \) справа.
* \( \text{O}: 3 \) слева, \( 3 \) справа.
* \( \text{H}: 6 \) слева, \( 6 \) справа.
* \( \text{I}: 6 \) слева, \( 4 + 2 = 6 \) справа. Теперь сходится.
7. \[ \text{FeCl}_3 + \text{HI} = \text{FeCl}_2 + \text{I}_2\downarrow + \text{HCl} \]
* Окислитель: \( \text{Fe}^{3+} \) (в \( \text{FeCl}_3 \)) принимает электрон, восстанавливается до \( \text{Fe}^{2+} \) (в \( \text{FeCl}_2 \)).
* Восстановитель: \( \text{I}^- \) (в \( \text{HI} \)) отдает электроны, окисляется до \( \text{I}_2^0 \) (в \( \text{I}_2\downarrow \)).
* Уравнение электронного баланса:
* \( \text{Fe}^{3+} + 1\text{e}^- \rightarrow \text{Fe}^{2+} \)
* \( 2\text{I}^- - 2\text{e}^- \rightarrow \text{I}_2^0 \)
* Коэффициенты: \( 2\text{Fe}^{3+} \) и \( 1\text{I}_2^0 \) (т.е. 2 \( \text{I}^- \)).
* Расставляем коэффициенты в уравнении:
\[ 2\text{FeCl}_3 + 2\text{HI} = 2\text{FeCl}_2 + \text{I}_2\downarrow + 2\text{HCl} \]
8. \[ \text{FeCl}_3 + \text{KI} = \text{FeCl}_2 + \text{I}_2\downarrow + \text{KCl} \]
* Окислитель: \( \text{Fe}^{3+} \) (в \( \text{FeCl}_3 \)) принимает электрон, восстанавливается до \( \text{Fe}^{2+} \) (в \( \text{FeCl}_2 \)).
* Восстановитель: \( \text{I}^- \) (в \( \text{KI} \)) отдает электроны, окисляется до \( \text{I}_2^0 \) (в \( \text{I}_2\downarrow \)).
* Урав