schoolХимия
verifiedРешено AI
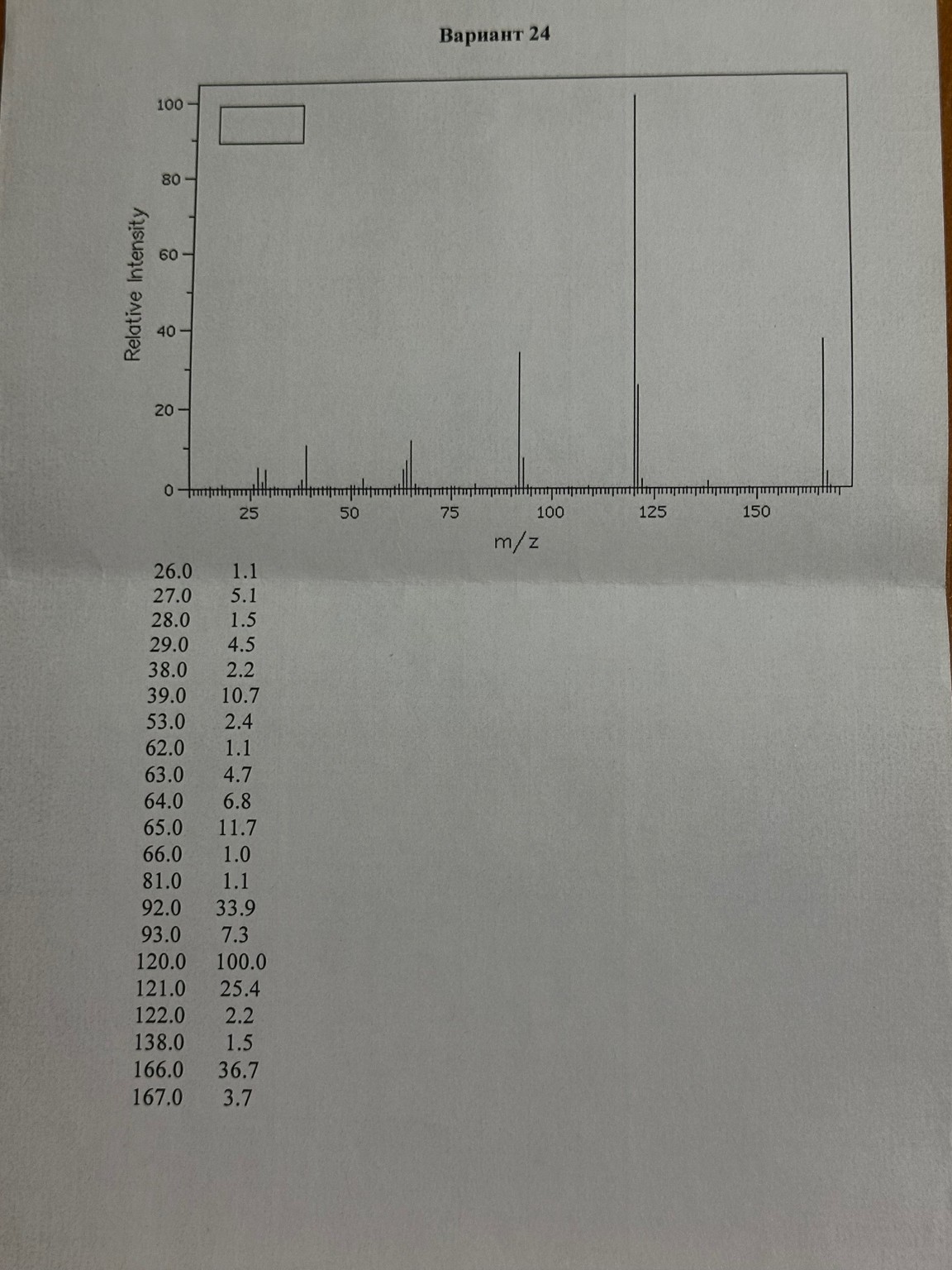
Решение задачи: Идентификация вещества по масс-спектру (m/z = 166)
help_outlineУсловие задачи
Реши задачу: Идентификация вещества по его масс-спектру Реши задачу: Идентификация вещества по его масс-спектру
lightbulbКраткий ответ
Вещество имеет молекулярную массу 166 г/моль. Анализ масс-спектра указывает на отщепление молекулы муравьиной кислоты или группы NO2, характерное для сложных эфиров или производных бензойной кислоты.
Подробное решение
Для идентификации вещества по представленному масс-спектру (Вариант 24) проведем поэтапный анализ пиков и фрагментации.
1. Определение молекулярной массы
В таблице данных самый тяжелый пик с заметной интенсивностью — это \(m/z = 166\) (интенсивность 36.7%). Пик \(m/z = 167\) является изотопным пиком \([M+1]^+\). Таким образом, молекулярная масса вещества \(M = 166\) г/моль.
2. Анализ базового пика
Базовый пик (100% интенсивности) находится при \(m/z = 120\).
Разница между молекулярным ионом и базовым пиком:
\[166 - 120 = 46\]
Потеря массы 46 характерна для отщепления молекулы муравьиной кислоты (\(HCOOH\)) или группы \(NO_2\). Однако, учитывая структуру органических молекул, такая потеря часто встречается у сложных эфиров или производных бензойной кислоты.
3. Анализ других значимых пиков
- \(m/z = 92\): Разница с базовым пиком \(120 - 92 = 28\). Это соответствует потере группы \(CO\) (оксид углерода).
- \(m/z = 65\): Характерный пик для ароматических соединений, образующийся при распаде бензольного кольца (циклопентадиенильный катион \([C_5H_5]^+\)).
- Соотношение пиков \(m/z = 120\) и \(m/z = 121\) (25.4%) указывает на наличие большого количества атомов углерода или специфическую структуру.
4. Интерпретация структуры
Масса 166 и характер фрагментации (потеря 46, затем 28) типичны для фталатов или производных бензойной кислоты.
Рассмотрим этиловый эфир салициловой кислоты (этилсалицилат).
Формула: \(HO-C_6H_4-COOC_2H_5\)
Вычислим молярную массу:
\[M = 9 \cdot 12 (C) + 10 \cdot 1 (H) + 3 \cdot 16 (O) = 108 + 10 + 48 = 166\]
Это точно соответствует нашему молекулярному иону.
Схема фрагментации этилсалицилата:
- Молекулярный ион: \(m/z = 166\).
- Потеря молекулы этанола (\(C_2H_5OH\), масса 46) в результате перегруппировки дает ион салициловой кислоты (или ангидрида) с \(m/z = 120\). Это и есть наш базовый пик.
- Последующая потеря \(CO\) (\(120 - 28\)) дает пик \(m/z = 92\) (фенольный фрагмент).
- Дальнейший распад приводит к пику \(m/z = 65\).
Вывод:
На основании молекулярной массы 166 и характерного базового пика 120 (потеря этанола), вещество идентифицировано как этиловый эфир салициловой кислоты.
Ответ: Этилсалицилат (этиловый эфир салициловой кислоты), \(C_9H_{10}O_3\).