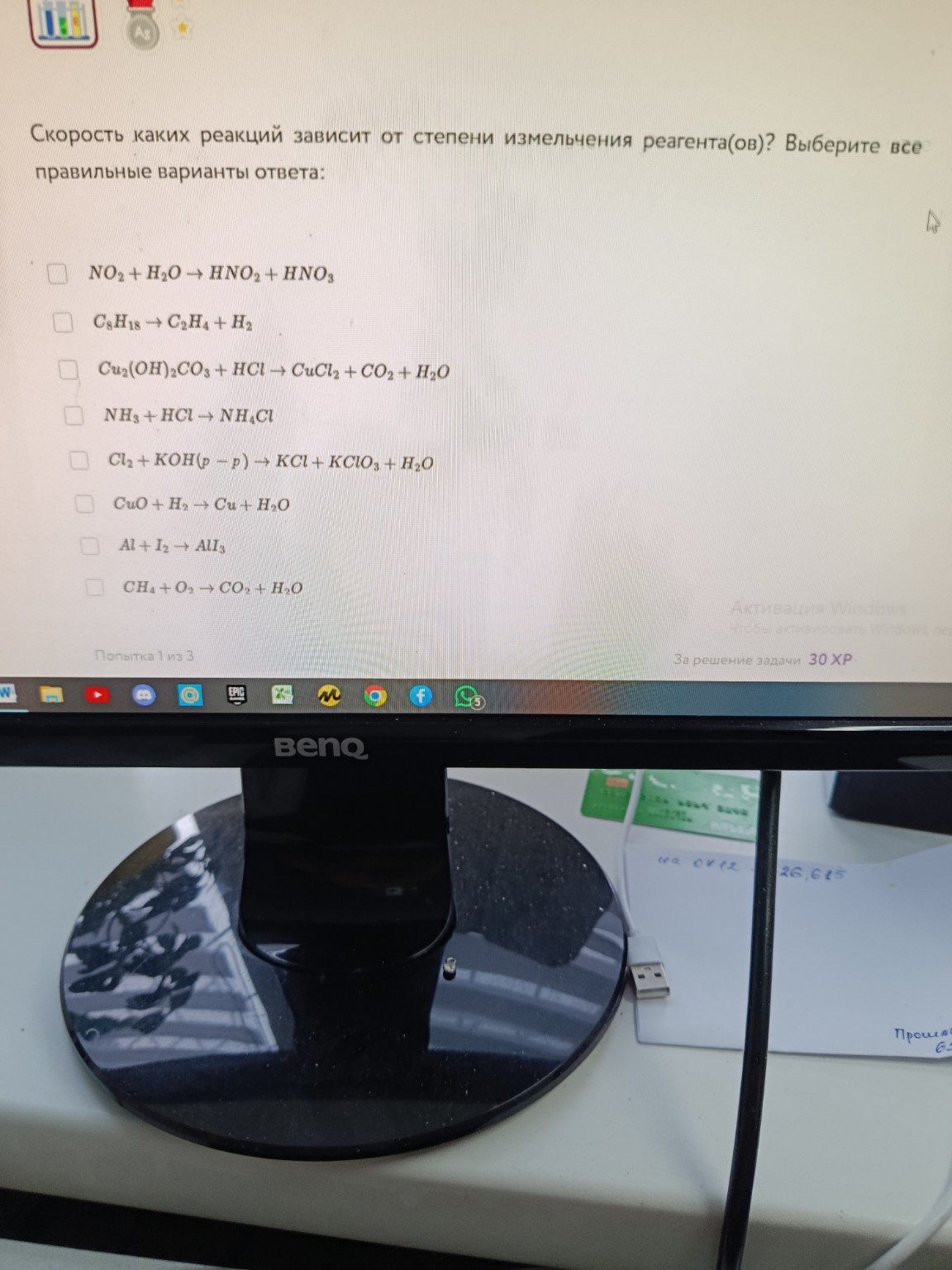
Реакции, скорость которых зависит от степени измельчения реагента(ов):
1. Реакция малахита с соляной кислотой:
\[Cu_2(OH)_2CO_3 (тв) + 4HCl (р-р) \rightarrow 2CuCl_2 (р-р) + CO_2 (г) + 3H_2O (ж)\]Здесь \(Cu_2(OH)_2CO_3\) (малахит) является твердым веществом. Чем мельче он измельчен, тем больше площадь его поверхности, доступной для реакции с раствором соляной кислоты, и тем быстрее протекает реакция.
2. Реакция оксида меди с водородом:
\[CuO (тв) + H_2 (г) \rightarrow Cu (тв) + H_2O (г)\]Здесь \(CuO\) (оксид меди) является твердым веществом. Чем мельче измельчен оксид меди, тем больше площадь его поверхности, доступной для реакции с газообразным водородом, и тем быстрее протекает реакция.
3. Реакция алюминия с йодом:
\[2Al (тв) + 3I_2 (тв) \rightarrow 2AlI_3 (тв)\]Здесь \(Al\) (алюминий) и \(I_2\) (йод) являются твердыми веществами. Чем мельче измельчены оба реагента, тем больше площадь их соприкосновения, и тем быстрее протекает реакция.