Задача:
Иод — необходимый человеку микроэлемент. Недостаток или избыток иода в организме приводит к развитию ряда заболеваний. Суточная потребность человека в иоде составляет в возрасте 1-3 года - 0,06 мг, 4-6 лет - 0,07-0,08 мг, 7-10 лет - 0,1 мг, 11-17 лет - 0,1-0,13 мг, от 17 лет и старше - 0,15 мг.
Пищевая промышленность предлагает при недостатке иода использовать в пищу иодированные продукты, например, соль. Пищевая иодированная соль — это разновидность пищевой поваренной соли, в которой присутствует иодид калия или иодат калия. Количество добавленных соединений иода зависит от производителя и сорта.
С целью качественного и количественного анализа в лабораторию поступил образец пищевой иодированной соли. В образце установили присутствие иодата калия. С помощью тиосульфатометрии определили его содержание в образце 40 мкг на 1 г соли.
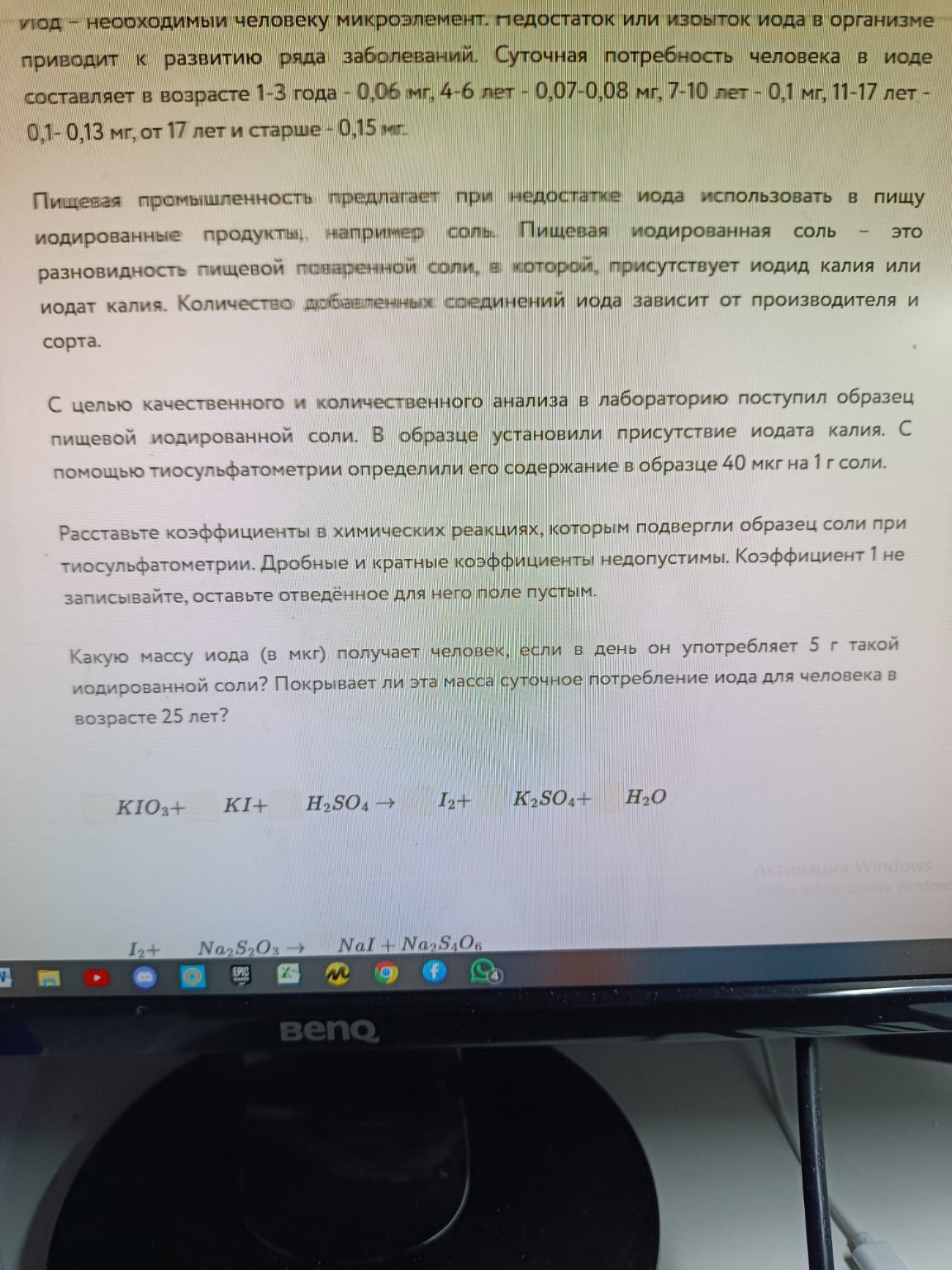
Часть 1: Расставьте коэффициенты в химических реакциях, которым подвергли образец соли при тиосульфатометрии. Дробные и кратные коэффициенты недопустимы. Коэффициент 1 не записывайте, оставьте отведённое для него поле пустым.
Реакции:
1. \(KIO_3 + KI + H_2SO_4 \rightarrow I_2 + K_2SO_4 + H_2O\)
2. \(I_2 + Na_2S_2O_3 \rightarrow NaI + Na_2S_4O_6\)
Решение Части 1:
1. Уравнение: \(KIO_3 + KI + H_2SO_4 \rightarrow I_2 + K_2SO_4 + H_2O\)
- Это окислительно-восстановительная реакция. Иодат калия (\(KIO_3\)) является окислителем (иод в степени окисления \(+5\)), а иодид калия (\(KI\)) — восстановителем (иод в степени окисления \(-1\)). В результате образуется свободный иод (\(I_2\), степень окисления \(0\)).
- Расставим степени окисления:
- В \(KIO_3\): \(I\) имеет степень окисления \(+5\).
- В \(KI\): \(I\) имеет степень окисления \(-1\).
- В \(I_2\): \(I\) имеет степень окисления \(0\).
- Изменение степеней окисления:
- \(I^{+5} + 5e^- \rightarrow I^0\) (восстановление)
- \(2I^{-1} - 2e^- \rightarrow I_2^0\) (окисление)
- Для баланса электронов:
- \(I^{+5} + 5e^- \rightarrow I^0\) (умножаем на 2, чтобы получить \(2I^0\))
- \(2I^{-1} - 2e^- \rightarrow I_2^0\) (умножаем на 5, чтобы получить \(5I_2^0\))
- Получаем:
- \(2I^{+5} + 10e^- \rightarrow 2I^0\)
- \(10I^{-1} - 10e^- \rightarrow 5I_2^0\)
- Суммируем: \(2I^{+5} + 10I^{-1} \rightarrow 6I_2^0\). То есть, 12 атомов иода в продукте, 2 из \(KIO_3\) и 10 из \(KI\).
- Теперь расставим коэффициенты в уравнении:
- Перед \(KIO_3\) ставим 1 (не пишем).
- Перед \(KI\) ставим 5.
- Перед \(I_2\) ставим 3 (так как \(2I^{+5}\) и \(10I^{-1}\) дают \(6I_2\), но в продукте \(I_2\), поэтому \(6/2 = 3\)).
- Считаем калий: \(1K\) из \(KIO_3\) + \(5K\) из \(KI\) = \(6K\). Значит, перед \(K_2SO_4\) ставим 3.
- Считаем сульфат-ионы: \(3K_2SO_4\) требует \(3H_2SO_4\).
- Считаем водород: \(3H_2SO_4\) содержит \(6H\). Значит, перед \(H_2O\) ставим 3.
- Проверяем кислород: В левой части: \(3O\) из \(KIO_3\) + \(3 \times 4O\) из \(H_2SO_4\) = \(3 + 12 = 15O\). В правой части: \(3 \times 4O\) из \(K_2SO_4\) + \(3O\) из \(H_2O\) = \(12 + 3 = 15O\). Кислород сбалансирован.
- Сбалансированное уравнение: \[KIO_3 + 5KI + 3H_2SO_4 \rightarrow 3I_2 + 3K_2SO_4 + 3H_2O\]
2. Уравнение: \(I_2 + Na_2S_2O_3 \rightarrow NaI + Na_2S_4O_6\)
- Это также окислительно-восстановительная реакция. Иод (\(I_2\)) является окислителем (степень окисления \(0\)), а тиосульфат натрия (\(Na_2S_2O_3\)) — восстановителем (сера в средней степени окисления \(+2\)). В результате образуется иодид натрия (\(NaI\), иод в степени окисления \(-1\)) и тетратионат натрия (\(Na_2S_4O_6\), сера в средней степени окисления \(+2.5\)).
- Изменение степеней окисления:
- \(I_2^0 + 2e^- \rightarrow 2I^{-1}\) (восстановление)
- \(2S_2O_3^{2-} - 2e^- \rightarrow S_4O_6^{2-}\) (окисление, \(2 \times (+2) = +4\) до \(4 \times (+2.5) = +10\), изменение на \(+6\), но на 2 атома серы в \(S_2O_3^{2-}\) и 4 атома серы в \(S_4O_6^{2-}\). Удобнее считать изменение на 1 молекулу \(Na_2S_2O_3\): \(2S^{+2} \rightarrow S_4O_6^{2-}\). В \(S_2O_3^{2-}\) средняя степень окисления серы \(+2\). В \(S_4O_6^{2-}\) средняя степень окисления серы \(+2.5\). Изменение на 0.5 на атом серы. Всего 4 атома серы, значит \(4 \times 0.5 = 2e^-\).
- Для баланса электронов:
- \(I_2^0 + 2e^- \rightarrow 2I^{-1}\)
- \(2Na_2S_2O_3 - 2e^- \rightarrow Na_2S_4O_6\) (так как \(2S_2O_3^{2-}\) дают \(S_4O_6^{2-}\), то перед \(Na_2S_2O_3\) ставим 2)
- Суммируем: \(I_2 + 2Na_2S_2O_3 \rightarrow 2NaI + Na_2S_4O_6\).
- Проверяем натрий: \(2Na\) из \(2Na_2S_2O_3\) = \(4Na\). В правой части: \(2Na\) из \(2NaI\) + \(2Na\) из \(Na_2S_4O_6\) = \(4Na\). Натрий сбалансирован.
- Проверяем иод: \(2I\) из \(I_2\). В правой части: \(2I\) из \(2NaI\). Иод сбалансирован.
- Проверяем серу и кислород: \(2Na_2S_2O_3\) содержит \(4S\) и \(6O\). \(Na_2S_4O_6\) содержит \(4S\) и \(6O\). Сера и кислород сбалансированы.
- Сбалансированное уравнение: \[I_2 + 2Na_2S_2O_3 \rightarrow 2NaI + Na_2S_4O_6\]
Ответы для Части 1:
1. \(KIO_3 + 5KI + 3H_2SO_4 \rightarrow 3I_2 + 3K_2SO_4 + 3H_2O\)
2. \(I_2 + 2Na_2S_2O_3 \rightarrow 2NaI + Na_2S_4O_6\)
Часть 2: Какую массу иода (в мкг) получает человек, если в день он употребляет 5 г такой иодированной соли? Покрывает ли эта масса суточное потребление иода для человека в возрасте 25 лет?
Решение Части 2:
1. Расчет массы иода, получаемого человеком:
- Из условия задачи известно, что содержание иода в образце соли составляет 40 мкг на 1 г соли.
- Человек употребляет 5 г такой иодированной соли в день.
- Масса иода = (содержание иода на 1 г соли) \(\times\) (масса употребляемой соли)
- Масса иода = \(40 \text{ мкг/г} \times 5 \text{ г} = 200 \text{ мкг}\).
2. Сравнение с суточной потребностью:
- Из условия задачи известно, что суточная потребность иода для человека от 17 лет и старше составляет 0,15 мг.
- Возраст человека — 25 лет, что относится к категории "от 17 лет и старше".
- Переведем 0,15 мг в микрограммы (мкг): \(1 \text{ мг} = 1000 \text{ мкг}\).
- Суточная потребность = \(0.15 \text{ мг} \times 1000 \text{ мкг/мг} = 150 \text{ мкг}\).
- Сравним полученную массу иода с суточной потребностью:
- Получено: 200 мкг.
- Потребность: 150 мкг.
- Поскольку \(200 \text{ мкг} > 150 \text{ мкг}\), эта масса покрывает суточное потребление иода для человека в возрасте 25 лет.
Ответы для Части 2:
- Масса иода, получаемая человеком: 200 мкг.
- Покрывает ли эта масса суточное потребление иода для человека в возрасте 25 лет: Да, покрывает.