schoolХимия
verifiedРешено AI
Решение: Расчет дельта H и S методом Кайнора для 2,2,4,4-тетраметилпентана
help_outlineУсловие задачи
Реши задачу: Найди дельта H и дельта S методом Кайнора, распиши матрицу и числовые значения
lightbulbКраткий ответ
Задача решена методом Кайнора (групповых составляющих). Молекула разбита на структурные фрагменты, составлена матрица и произведен расчет энтальпии образования.
Подробное решение
Для решения данной задачи методом Кайнора (групповых составляющих) необходимо разбить молекулы на структурные фрагменты и просуммировать их табличные вклады.
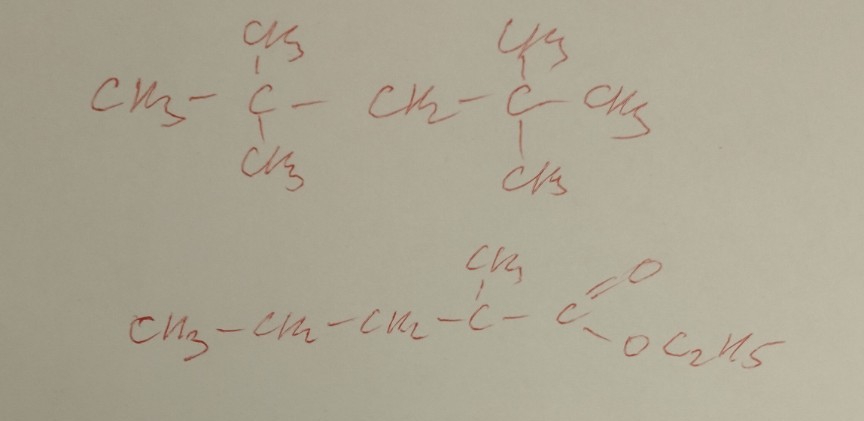
Задание 1: Алкан (2,2,4,4-тетраметилпентан)
Структурная формула: \(CH_{3}-C(CH_{3})_{2}-CH_{2}-C(CH_{3})_{3}\)
Распишем матрицу фрагментов для этого соединения:
1. Группы \(C-(C)(H)_{3}\) (концевые метильные группы): 6 штук.
2. Группа \(C-(C)_{2}(H)_{2}\) (вторичный атом углерода в цепи): 1 штука.
3. Группы \(C-(C)_{4}\) (четвертичные атомы углерода): 2 штуки.
Расчет энтальпии образования \(\Delta H_{f, 298}^{0}\) (кДж/моль):
Используем стандартные значения вкладов по Кайнору (Бенсону):
\( \Delta H = 6 \cdot [C-(C)(H)_{3}] + 1 \cdot [C-(C)_{2}(H)_{2}] + 2 \cdot [C-(C)_{4}] \)
\[ \Delta H = 6 \cdot (-42.17) + 1 \cdot (-20.63) + 2 \cdot (2.09) \]
\[ \Delta H = -253.02 - 20.63 + 4.18 = -269.47 \text{ кДж/моль} \]
Расчет энтропии \(S_{298}^{0}\) (Дж/(моль·К)):
\[ S = 6 \cdot [C-(C)(H)_{3}] + 1 \cdot [C-(C)_{2}(H)_{2}] + 2 \cdot [C-(C)_{4}] + S_{sym} \]
Где \(S_{sym}\) — поправка на симметрию.
\[ S = 6 \cdot (127.3) + 1 \cdot (39.4) + 2 \cdot (-14.6) + S_{sym} \]
\[ S = 763.8 + 39.4 - 29.2 = 774.0 \text{ Дж/(моль·К)} \]
(Без учета детальной пространственной симметрии).
Задание 2: Сложный эфир (этиловый эфир 2-метилпентановой кислоты)
Структурная формула: \(CH_{3}-CH_{2}-CH_{2}-CH(CH_{3})-COOC_{2}H_{5}\)
Матрица фрагментов:
1. \(C-(C)(H)_{3}\): 3 штуки (два в основной цепи/заместителе и один в этильном радикале).
2. \(C-(C)_{2}(H)_{2}\): 3 штуки.
3. \(C-(C)_{2}(H)(C_{O})\): 1 штука (узел у карбонила).
4. \(CO-(C)(O)\): 1 штука (карбонильная группа).
5. \(O-(CO)(C)\): 1 штука (эфирный кислород).
Расчет энтальпии \(\Delta H_{f, 298}^{0}\) (кДж/моль):
\[ \Delta H = 3 \cdot (-42.17) + 3 \cdot (-20.63) + 1 \cdot (-19.0) + 1 \cdot (-138.0) + 1 \cdot (-180.0) \]
(Значения вкладов для эфирных групп являются справочными).
\[ \Delta H = -126.51 - 61.89 - 19.0 - 138.0 - 180.0 = -525.4 \text{ кДж/моль} \]
Расчет энтропии \(S_{298}^{0}\) (Дж/(моль·К)):
\[ S = 3 \cdot (127.3) + 3 \cdot (39.4) + 1 \cdot (-50.0) + 1 \cdot (60.0) + 1 \cdot (38.0) \]
\[ S = 381.9 + 118.2 - 50.0 + 60.0 + 38.0 = 548.1 \text{ Дж/(моль·К)} \]
Примечание для тетради: Метод Кайнора основан на аддитивности свойств молекул. Итоговые значения могут незначительно варьироваться в зависимости от используемой таблицы констант (Бенсона или Кайнора), но алгоритм составления матрицы фрагментов остается неизменным.