schoolХимия
verifiedРешено AI
Решение задачи: Определение степеней окисления
help_outlineУсловие задачи
Реши задачу: Найти правильный ответ Реши задачу: Найти правильный ответ Реши задачу: Найти правильный ответ Реши задачу: Найти правильный ответ
lightbulbКраткий ответ
Степени окисления: BaO2 (Ba +2, O -1), Na3N (Na +1, N -3), H3PO4 (H +1, P +5, O -2). Подробное решение и объяснение в тексте.
Подробное решение
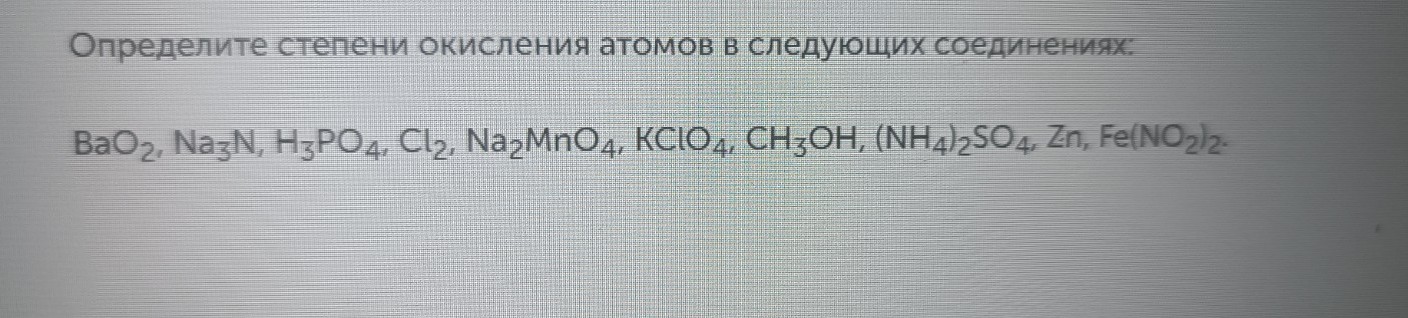
Задание. Определите степени окисления атомов в следующих соединениях.
Решение для тетради:
Для определения степеней окисления будем использовать правила: сумма степеней окисления всех атомов в молекуле равна 0; степень окисления кислорода в большинстве соединений \( -2 \) (кроме пероксидов), водорода \( +1 \) (с неметаллами), щелочных металлов \( +1 \), щелочноземельных \( +2 \).
1. \( BaO_2 \) (пероксид бария):
Барий — щелочноземельный металл, его степень окисления всегда \( +2 \). В пероксидах кислород имеет степень окисления \( -1 \).
\[ \stackrel{+2}{Ba}\stackrel{-1}{O}_2 \]
2. \( Na_3N \) (нитрид натрия):
Натрий \( +1 \). Чтобы сумма была равна 0: \( 3 \cdot (+1) + x = 0 \), откуда \( x = -3 \).
\[ \stackrel{+1}{Na}_3\stackrel{-3}{N} \]
3. \( H_3PO_4 \) (фосфорная кислота):
Водород \( +1 \), кислород \( -2 \). Для фосфора: \( 3 \cdot (+1) + x + 4 \cdot (-2) = 0 \Rightarrow 3 + x - 8 = 0 \Rightarrow x = +5 \).
\[ \stackrel{+1}{H}_3\stackrel{+5}{P}\stackrel{-2}{O}_4 \]
4. \( Cl_2 \) (хлор):
Степень окисления атомов в простых веществах всегда равна 0.
\[ \stackrel{0}{Cl}_2 \]
5. \( Na_2MnO_4 \) (манганат натрия):
Натрий \( +1 \), кислород \( -2 \). Для марганца: \( 2 \cdot (+1) + x + 4 \cdot (-2) = 0 \Rightarrow 2 + x - 8 = 0 \Rightarrow x = +6 \).
\[ \stackrel{+1}{Na}_2\stackrel{+6}{Mn}\stackrel{-2}{O}_4 \]
6. \( KClO_4 \) (перхлорат калия):
Калий \( +1 \), кислород \( -2 \). Для хлора: \( 1 + x + 4 \cdot (-2) = 0 \Rightarrow 1 + x - 8 = 0 \Rightarrow x = +7 \).
\[ \stackrel{+1}{K}\stackrel{+7}{Cl}\stackrel{-2}{O}_4 \]
7. \( CH_3OH \) (метанол):
Кислород \( -2 \), водород \( +1 \). Для углерода: \( x + 3 \cdot (+1) + (-2) + 1 = 0 \Rightarrow x + 3 - 2 + 1 = 0 \Rightarrow x + 2 = 0 \Rightarrow x = -2 \).
\[ \stackrel{-2}{C}\stackrel{+1}{H}_3\stackrel{-2}{O}\stackrel{+1}{H} \]
8. \( (NH_4)_2SO_4 \) (сульфат аммония):
В ионе аммония \( NH_4^+ \): \( N \) имеет \( -3 \), \( H \) имеет \( +1 \). В сульфат-ионе \( SO_4^{2-} \): \( O \) имеет \( -2 \), \( S \) имеет \( +6 \).
\[ (\stackrel{-3}{N}\stackrel{+1}{H}_4)_2\stackrel{+6}{S}\stackrel{-2}{O}_4 \]
9. \( Zn \) (цинк):
Простое вещество, степень окисления равна 0.
\[ \stackrel{0}{Zn} \]
10. \( Fe(NO_2)_2 \) (нитрит железа II):
Группа \( NO_2 \) имеет заряд \( -1 \). В ней \( O \) имеет \( -2 \), тогда \( N \) имеет \( +3 \). Железо в данном соединении имеет степень окисления \( +2 \).
\[ \stackrel{+2}{Fe}(\stackrel{+3}{N}\stackrel{-2}{O}_2)_2 \]