schoolХимия
verifiedРешено AI
Решение задачи: ZnSO4 + (NH4)2S (1 вариант)
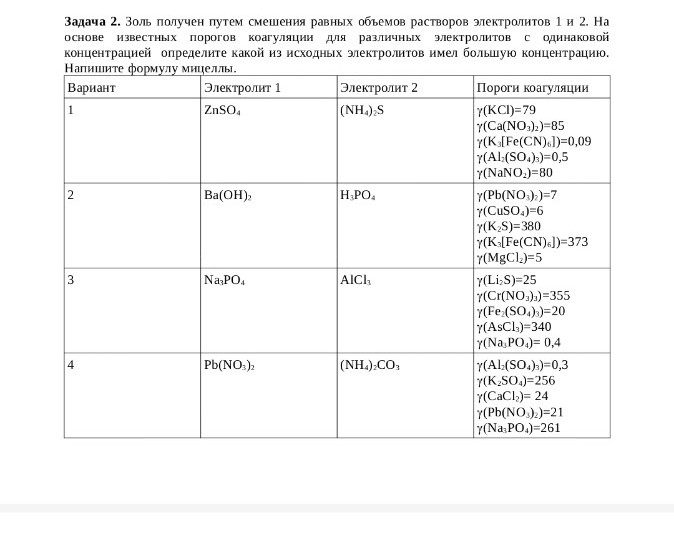
help_outlineУсловие задачи
Реши задачу: Первый вариант Реши задачу: Первый вариант
lightbulbКраткий ответ
При взаимодействии ZnSO4 и (NH4)2S образуется нерастворимый сульфид цинка (ZnS). Анализ порогов коагуляции позволяет определить электролит, находящийся в избытке.
Подробное решение
Задача 2. Определение формулы мицеллы и исходного электролита с большей концентрацией.
Дано:
Вариант: 1
Электролит 1: \(ZnSO_4\)
Электролит 2: \((NH_4)_2S\)
Пороги коагуляции \(\gamma\) (ммоль/л):
\(\gamma(KCl) = 79\)
\(\gamma(Ca(NO_3)_2) = 85\)
\(\gamma(K_3[Fe(CN)_6]) = 0,09\)
\(\gamma(Al_2(SO_4)_3) = 0,5\)
\(\gamma(NaNO_2) = 80\)
Решение:
1. Определим продукт реакции между электролитами \(ZnSO_4\) и \((NH_4)_2S\).
При смешении растворов этих электролитов происходит реакция обмена:
\[ZnSO_4 + (NH_4)_2S \rightarrow ZnS \downarrow + (NH_4)_2SO_4\]
Образуется нерастворимый сульфид цинка \(ZnS\), который является основой для образования золя.
2. Определим, какой из электролитов находится в избытке.
Для этого проанализируем пороги коагуляции. Пороги коагуляции даны для различных электролитов. Нас интересуют ионы, которые могут быть потенциалопределяющими или противоионами.
Согласно правилу Шульце-Гарди, коагулирующая способность иона тем выше, чем больше его заряд. При этом коагуляцию вызывают ионы, заряд которых противоположен заряду гранулы.
В данном случае, среди порогов коагуляции есть очень низкие значения для \(K_3[Fe(CN)_6]\) (0,09 ммоль/л) и \(Al_2(SO_4)_3\) (0,5 ммоль/л).
Ион \([Fe(CN)_6]^{3-}\) имеет заряд -3.
Ион \(Al^{3+}\) имеет заряд +3.
Очень низкий порог коагуляции для \(K_3[Fe(CN)_6]\) (содержащего анион \([Fe(CN)_6]^{3-}\)) указывает на то, что гранула золя имеет положительный заряд. Это означает, что в адсорбционном слое находятся положительно заряженные ионы.
Если бы гранула была отрицательно заряжена, то низкий порог коагуляции был бы для \(Al_2(SO_4)_3\) (содержащего катион \(Al^{3+}\)). Однако порог для \(Al_2(SO_4)_3\) выше, чем для \(K_3[Fe(CN)_6]\), что подтверждает положительный заряд гранулы.
3. Определим, какой из исходных электролитов был в избытке.
Гранула \(ZnS\) заряжается положительно, если в избытке находится электролит, содержащий катионы, способные адсорбироваться на поверхности \(ZnS\). В данном случае это \(Zn^{2+}\) из \(ZnSO_4\).
Если бы в избытке был \((NH_4)_2S\), то на поверхности \(ZnS\) адсорбировались бы анионы \(S^{2-}\), и гранула была бы отрицательно заряжена.
Поскольку гранула заряжена положительно, это означает, что в избытке был электролит 1, то есть \(ZnSO_4\).
4. Напишем формулу мицеллы.
Ядро мицеллы: \(nZnS\)
Потенциалопределяющие ионы (адсорбированные на поверхности ядра): \(mZn^{2+}\) (избыток \(ZnSO_4\))
Адсорбционный слой: \((nZnS) \cdot mZn^{2+}\)
Противоионы (из \(ZnSO_4\) и \((NH_4)_2SO_4\)): \((2m-x)SO_4^{2-}\)
Диффузный слой: \(xSO_4^{2-}\)
Таким образом, формула мицеллы:
\[\{[nZnS] \cdot mZn^{2+} \cdot (2m-x)SO_4^{2-}\} \cdot xSO_4^{2-}\]
Или, более общая форма, учитывая, что противоионы могут быть из обоих электролитов, но в основном из того, который был в избытке:
\[\{[nZnS] \cdot mZn^{2+}\}_{положительно заряженная гранула} \cdot (2m-x)SO_4^{2-}_{адсорбционный слой} \cdot xSO_4^{2-}_{диффузный слой}\]
Ответ:
1. Исходный электролит, имевший большую концентрацию, – это \(ZnSO_4\).
2. Формула мицеллы: \(\{ [nZnS] \cdot mZn^{2+} \cdot (2m-x)SO_4^{2-} \} \cdot xSO_4^{2-}\)