Задача 3.
По масс-спектру соединения определите, к какому классу оно принадлежит, и установите его структурную формулу.
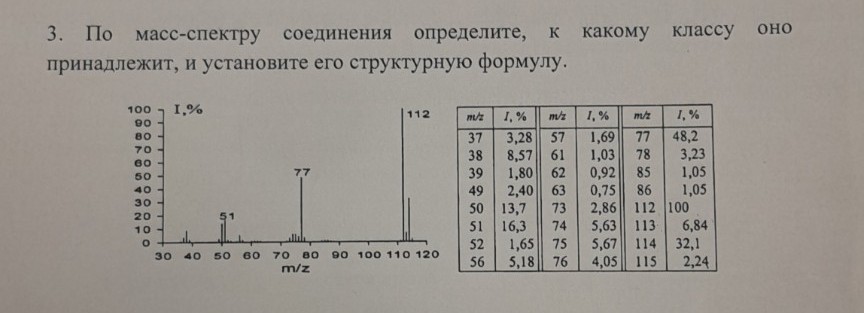
Данные масс-спектра:
m/z 112 (100%) - базовый пик
m/z 113 (6.84%)
m/z 114 (32.1%)
m/z 77 (48.2%)
m/z 51 (16.3%)
m/z 50 (13.7%)
и другие пики меньшей интенсивности.
Решение:
1. Определение молекулярной массы (M).
Молекулярный ион (M+) обычно является пиком с наибольшим значением m/z, если он достаточно стабилен. В данном спектре самый тяжелый пик с заметной интенсивностью - это m/z 114 (32.1%). Однако, базовый пик (самый интенсивный) - это m/z 112 (100%). Это указывает на то, что пик m/z 114 является молекулярным ионом (M+), а пик m/z 112 - это фрагмент, образовавшийся в результате потери двух водородов или другого стабильного фрагмента, или же это M+, а пик 114 - это M+2.
Давайте предположим, что M+ = 114.
Тогда пик M+1 = 115 (2.24%).
Пик M+2 = 116 (не указан, но если бы был, то был бы очень мал).
Если M+ = 114, то:
Интенсивность M+1 (m/z 115) = 2.24%.
Рассчитаем количество атомов углерода (nC) по пику M+1:
\[ n_C = \frac{I_{M+1}}{I_M} \times \frac{100}{1.1} = \frac{2.24}{32.1} \times \frac{100}{1.1} \approx 0.06978 \times 90.9 \approx 6.34 \]Округляем до ближайшего целого: nC = 6.
Теперь рассмотрим пик M+2 (m/z 114) относительно M (m/z 112). Если M = 112, то M+2 = 114. Интенсивность M+2 = 32.1%.
Такая высокая интенсивность пика M+2 (32.1%) относительно M (100%) указывает на наличие атомов хлора (Cl) или брома (Br).
- Если есть один атом хлора (Cl), то соотношение 35Cl : 37Cl составляет примерно 3 : 1. То есть, пик M+2 будет составлять около 33% от пика M.
- Если есть один атом брома (Br), то соотношение 79Br : 81Br составляет примерно 1 : 1. То есть, пик M+2 будет составлять около 98-100% от пика M.
Поскольку интенсивность пика m/z 114 составляет 32.1% от пика m/z 112 (который является базовым, 100%), это очень сильно указывает на наличие одного атома хлора (Cl) в соединении.
Таким образом, молекулярный ион (M+) имеет массу 112 (для 35Cl) и 114 (для 37Cl).
Молекулярная масса (M) = 112.
2. Определение брутто-формулы.
Мы знаем, что M = 112 и в соединении есть один атом хлора (Cl, масса 35).
Остаток массы = 112 - 35 = 77.
Этот остаток массы (77) должен приходиться на атомы углерода и водорода.
Предположим, что это ароматическое соединение, так как пик m/z 77 очень интенсивный (48.2%). Пик m/z 77 характерен для фенильного радикала (C6H5+).
Масса C6H5 = (6 * 12) + (5 * 1) = 72 + 5 = 77.
Это идеально совпадает с остатком массы 77.
Таким образом, брутто-формула соединения: C6H5Cl.
3. Проверка брутто-формулы C6H5Cl.
- Молекулярная масса: (6 * 12) + (5 * 1) + (1 * 35) = 72 + 5 + 35 = 112. (Совпадает с M для 35Cl).
- Пик M+1 (m/z 113):
Вклад от 13C: \(6 \times 1.1\% = 6.6\%\).
Наблюдаемый M+1 = 6.84%. Это очень близко к 6.6%.
- Пик M+2 (m/z 114):
Вклад от 37Cl: 32.5% от M.
Наблюдаемый M+2 = 32.1%. Это очень близко к 32.5%.
Все данные подтверждают брутто-формулу C6H5Cl.
4. Определение класса соединения и структурной формулы.
Соединение C6H5Cl содержит бензольное кольцо (C6H5) и атом хлора (Cl).
Класс соединения: Арилгалогенид (или галогенбензол).
Структурная формула: Хлорбензол.
\[ \text{C}_6\text{H}_5\text{Cl} \]
или
\[ \begin{array}{c} \text{Cl} \\ | \\ \text{C}_6\text{H}_5 \end{array} \]
5. Анализ фрагментационных пиков.
- m/z 77 (48.2%): Это пик фенильного катиона (C6H5+), образующегося при отщеплении атома хлора (Cl) от молекулярного иона.
M+ (C6H5Cl) - Cl• \(\rightarrow\) C6H5+ (m/z 77)
- m/z 51 (16.3%) и m/z 50 (13.7%): Эти пики характерны для фрагментов бензольного кольца.
C6H5+ (m/z 77) - C2H2 \(\rightarrow\) C4H3+ (m/z 51)
C6H5+ (m/z 77) - C2H3 \(\rightarrow\) C4H2+ (m/z 50)
Все фрагментационные пики согласуются со структурой хлорбензола.
Вывод:
По масс-спектру установлено, что соединение принадлежит к классу арилгалогенидов (галогенбензолов).
Его структурная формула: хлорбензол.
\[ \begin{array}{c} \text{Cl} \\ | \\ \text{C}_6\text{H}_5 \end{array} \]