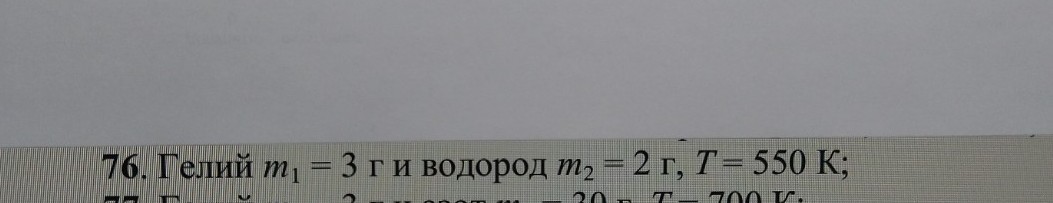Задача 76
В сосуде вместимостью \(V = 0,01 \text{ м}^3\) содержится смесь двух газов: гелий массой \(m_1 = 3 \text{ г}\) и водород массой \(m_2 = 2 \text{ г}\), при температуре \(T = 550 \text{ К}\). Определить давление \(p\), концентрацию \(n\) и плотность \(\rho\) смеси газов.
Дано:
- Объем сосуда: \(V = 0,01 \text{ м}^3\)
- Масса гелия: \(m_1 = 3 \text{ г} = 3 \cdot 10^{-3} \text{ кг}\)
- Масса водорода: \(m_2 = 2 \text{ г} = 2 \cdot 10^{-3} \text{ кг}\)
- Температура: \(T = 550 \text{ К}\)
Найти:
- Давление смеси: \(p\)
- Концентрация смеси: \(n\)
- Плотность смеси: \(\rho\)
Решение:
Для решения задачи нам понадобятся следующие физические константы и молярные массы газов:
- Универсальная газовая постоянная: \(R = 8,31 \text{ Дж}/(\text{моль} \cdot \text{К})\)
- Постоянная Больцмана: \(k = 1,38 \cdot 10^{-23} \text{ Дж}/\text{К}\)
- Число Авогадро: \(N_A = 6,022 \cdot 10^{23} \text{ моль}^{-1}\)
- Молярная масса гелия (He): \(M_1 = 4 \text{ г}/\text{моль} = 4 \cdot 10^{-3} \text{ кг}/\text{моль}\)
- Молярная масса водорода (H2): \(M_2 = 2 \text{ г}/\text{моль} = 2 \cdot 10^{-3} \text{ кг}/\text{моль}\)
1. Определим давление смеси газов \(p\).
Давление смеси газов можно найти, используя уравнение Менделеева-Клапейрона для каждого газа, а затем сложить их давления (закон Дальтона), или применить его для всей смеси. Удобнее использовать его для всей смеси, предварительно найдя общее количество вещества (число молей) в смеси.
Число молей гелия \(\nu_1\):
\[\nu_1 = \frac{m_1}{M_1}\] \[\nu_1 = \frac{3 \cdot 10^{-3} \text{ кг}}{4 \cdot 10^{-3} \text{ кг}/\text{моль}} = 0,75 \text{ моль}\]Число молей водорода \(\nu_2\):
\[\nu_2 = \frac{m_2}{M_2}\] \[\nu_2 = \frac{2 \cdot 10^{-3} \text{ кг}}{2 \cdot 10^{-3} \text{ кг}/\text{моль}} = 1 \text{ моль}\]Общее число молей смеси \(\nu\):
\[\nu = \nu_1 + \nu_2\] \[\nu = 0,75 \text{ моль} + 1 \text{ моль} = 1,75 \text{ моль}\]Теперь используем уравнение Менделеева-Клапейрона для смеси:
\[pV = \nu RT\]Отсюда давление \(p\):
\[p = \frac{\nu RT}{V}\] \[p = \frac{1,75 \text{ моль} \cdot 8,31 \text{ Дж}/(\text{моль} \cdot \text{К}) \cdot 550 \text{ К}}{0,01 \text{ м}^3}\] \[p = \frac{1,75 \cdot 8,31 \cdot 550}{0,01} \text{ Па}\] \[p = \frac{7999,875}{0,01} \text{ Па}\] \[p = 799987,5 \text{ Па} \approx 8,0 \cdot 10^5 \text{ Па}\]2. Определим концентрацию смеси газов \(n\).
Концентрация \(n\) - это число молекул в единице объема. Сначала найдем общее число молекул в смеси.
Общее число молекул \(N\):
\[N = \nu \cdot N_A\] \[N = 1,75 \text{ моль} \cdot 6,022 \cdot 10^{23} \text{ моль}^{-1}\] \[N = 10,5385 \cdot 10^{23} = 1,05385 \cdot 10^{24} \text{ молекул}\]Теперь найдем концентрацию \(n\):
\[n = \frac{N}{V}\] \[n = \frac{1,05385 \cdot 10^{24} \text{ молекул}}{0,01 \text{ м}^3}\] \[n = 105,385 \cdot 10^{24} \text{ м}^{-3} = 1,05385 \cdot 10^{26} \text{ м}^{-3}\]Округлим до двух значащих цифр, как и в давлении:
\[n \approx 1,05 \cdot 10^{26} \text{ м}^{-3}\]3. Определим плотность смеси газов \(\rho\).
Плотность смеси \(\rho\) - это отношение общей массы смеси к ее объему.
Общая масса смеси \(m_{общ}\):
\[m_{общ} = m_1 + m_2\] \[m_{общ} = 3 \cdot 10^{-3} \text{ кг} + 2 \cdot 10^{-3} \text{ кг} = 5 \cdot 10^{-3} \text{ кг}\]Плотность смеси \(\rho\):
\[\rho = \frac{m_{общ}}{V}\] \[\rho = \frac{5 \cdot 10^{-3} \text{ кг}}{0,01 \text{ м}^3}\] \[\rho = \frac{0,005}{0,01} \text{ кг}/\text{м}^3\] \[\rho = 0,5 \text{ кг}/\text{м}^3\]Ответ:
- Давление смеси: \(p \approx 8,0 \cdot 10^5 \text{ Па}\)
- Концентрация смеси: \(n \approx 1,05 \cdot 10^{26} \text{ м}^{-3}\)
- Плотность смеси: \(\rho = 0,5 \text{ кг}/\text{м}^3\)