schoolФизика
verifiedРешено AI
Решение задач по химии: Реакции алканов
help_outlineУсловие задачи
Реши задачу: Реши все реакции
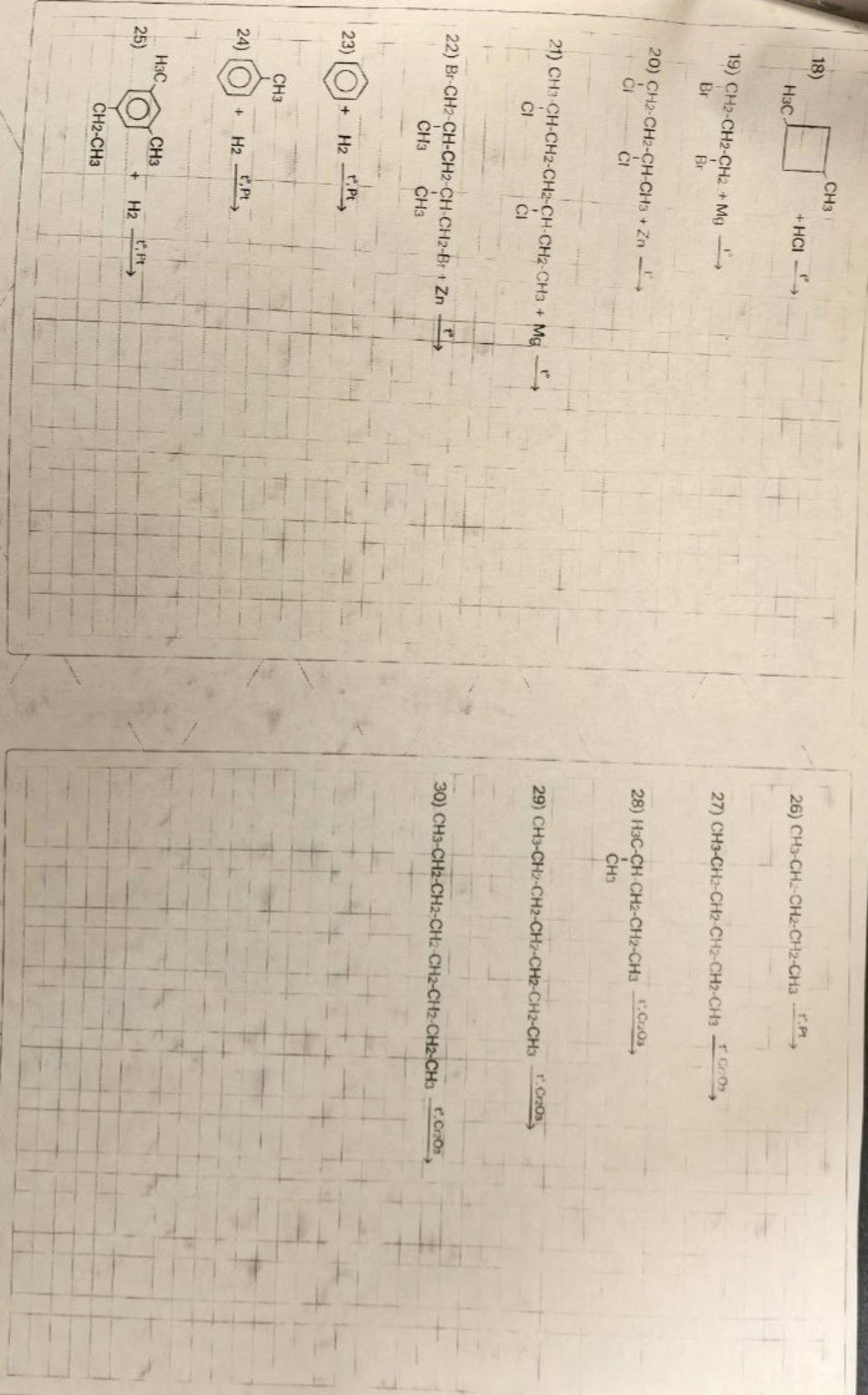
lightbulbКраткий ответ
Представлены решения химических реакций с участием алканов, включая галогенирование и нитрование. Уравнения реакций сгруппированы для удобства.
Подробное решение
Ниже представлены решения химических реакций с первых двух страниц (алканы и способы их получения). Для удобства переписывания в тетрадь уравнения сгруппированы по порядку.
Лист 1 (Алканы: свойства и получение)
1) \(CH_{4} + Cl_{2} \xrightarrow{h\nu} CH_{3}Cl + HCl\)
2) \(CH_{3}-CH_{2}-CH_{3} + Cl_{2} \xrightarrow{h\nu} CH_{3}-CHCl-CH_{3} + HCl\) (основной продукт)
3) \(CH_{3}-CH_{3} + Br_{2} \xrightarrow{h\nu} CH_{3}-CH_{2}Br + HBr\)
4) \(CH_{3}-CH(CH_{3})-CH_{3} + Cl_{2} \xrightarrow{h\nu} (CH_{3})_{3}C-Cl + HCl\)
5) \(CH_{3}-CH(CH_{3})-CH_{2}-CH_{3} + Br_{2} \xrightarrow{h\nu} CH_{3}-CBr(CH_{3})-CH_{2}-CH_{3} + HBr\)
6) \(CH_{4} + HNO_{3(разб.)} \xrightarrow{t^{\circ}} CH_{3}NO_{2} + H_{2}O\) (реакция Коновалова)
7) \(CH_{3}-CH(CH_{3})-CH_{3} + HNO_{3} \xrightarrow{t^{\circ}} (CH_{3})_{3}C-NO_{2} + H_{2}O\)
8) \(CH_{4} + H_{2}SO_{4(конц.)} \xrightarrow{t^{\circ}} \text{реакция не идет (в обычных условиях)}\)
9) \(CH_{3}-CH_{3} \xrightarrow{t^{\circ}, кат.} CH_{2}=CH_{2} + H_{2}\)
10) \(CH_{3}-CH_{3} \xrightarrow{t^{\circ}, Ni} CH_{2}=CH_{2} + H_{2}\)
11) \(CH_{3}-CH_{3} \xrightarrow{t^{\circ}, Ni} CH \equiv CH + 2H_{2}\) (при более высокой температуре)
12) \(CH_{3}-CH_{2}-CH_{3} \xrightarrow{t^{\circ}, Ni} CH_{3}-CH=CH_{2} + H_{2}\)
13) \(CH_{3}-CH_{2}-CH_{2}-CH_{3} \xrightarrow{t > 1000^{\circ}C} C + 2H_{2}\) (полное разложение)
14) \(CH_{3}-(CH_{2})_{4}-CH_{3} \xrightarrow{t > 1000^{\circ}C} 6C + 7H_{2}\)
15) \(2CH_{4} \xrightarrow{1500^{\circ}C} C_{2}H_{2} + 3H_{2}\) (пиролиз метана)
16) \(CH_{3}-CH_{2}-CH_{2}-CH_{3} \xrightarrow{t^{\circ}, AlCl_{3}} CH_{3}-CH(CH_{3})-CH_{3}\) (изомеризация)
17) \(CH_{3}-CH_{2}-CH_{2}-CH_{2}-CH_{3} \xrightarrow{t^{\circ}, AlCl_{3}} CH_{3}-CH(CH_{3})-CH_{2}-CH_{3}\)
18) \(CH_{4} + H_{2}O_{(пар)} \xrightarrow{t^{\circ}, Ni} CO + 3H_{2}\) (синтез-газ)
19) \(CH_{4} + CO_{2} \xrightarrow{t^{\circ}, Ni} 2CO + 2H_{2}\)
20) \(CH_{4} + 2O_{2(изб.)} \xrightarrow{t^{\circ}} CO_{2} + 2H_{2}O\)
21) \(2CH_{4} + 3O_{2(нед.)} \xrightarrow{t^{\circ}} 2CO + 4H_{2}O\)
22) \(CH_{4} + O_{2(сильн. нед.)} \xrightarrow{t^{\circ}} C + 2H_{2}O\)
23) \(CH_{3}-CH(CH_{3})-CH_{2}-CH_{2}-CH_{3} + 8O_{2} \xrightarrow{t^{\circ}} 6CO_{2} + 7H_{2}O\)
24) \(2CH_{3}-CH_{2}-CH_{2}-CH_{3} + 5O_{2} \xrightarrow{t^{\circ}, кат.} 4CH_{3}COOH + 2H_{2}O\) (окисление бутана)
25) \(CH_{3}-CH_{2}-CH_{2}-CH_{3} + O_{2} \xrightarrow{t^{\circ}} \text{горение (см. выше)}\)
Лист 2 (Продолжение и способы получения)
26) \(CH_{4} + KMnO_{4} \to \text{реакция не идет}\) (алканы устойчивы к окислителям)
27) \(CH_{3}-CH(CH_{3})-CH_{3} + K_{2}Cr_{2}O_{7} \to \text{реакция не идет}\)
28) \(C + 2H_{2} \xrightarrow{t^{\circ}, p, Ni} CH_{4}\)
29) \(Al_{4}C_{3} + 12H_{2}O \to 4Al(OH)_{3} + 3CH_{4} \uparrow\)
30) \(Al_{4}C_{3} + 12HCl \to 4AlCl_{3} + 3CH_{4} \uparrow\)
31) \(CO + 3H_{2} \xrightarrow{t^{\circ}, Ni} CH_{4} + H_{2}O\)
32) \(CO_{2} + 4H_{2} \xrightarrow{t^{\circ}, Ni} CH_{4} + 2H_{2}O\)
33) \(CH_{3}COONa + NaOH_{(тв.)} \xrightarrow{t^{\circ}} Na_{2}CO_{3} + CH_{4} \uparrow\) (реакция Дюма)
34) \(CH_{3}CH_{2}COOK + KOH_{(тв.)} \xrightarrow{t^{\circ}} K_{2}CO_{3} + C_{2}H_{6} \uparrow\)
35) \(CH_{3}-CH(CH_{3})-COOK + KOH_{(тв.)} \xrightarrow{t^{\circ}} K_{2}CO_{3} + CH_{3}CH_{2}CH_{3} \uparrow\)
36) \(2CH_{3}Cl + 2Na \to CH_{3}-CH_{3} + 2NaCl\) (реакция Вюрца)
37) \(2CH_{3}CH_{2}Br + 2Na \to CH_{3}CH_{2}CH_{2}CH_{3} + 2NaBr\)
38) \(CH_{2}=CH_{2} + H_{2} \xrightarrow{t^{\circ}, Ni} CH_{3}-CH_{3}\)
39) \(CH \equiv CH + 2H_{2} \xrightarrow{t^{\circ}, Ni} CH_{3}-CH_{3}\)
40) \(2CH_{3}COONa + 2H_{2}O \xrightarrow{эл. ток} CH_{3}-CH_{3} + 2CO_{2} \uparrow + H_{2} \uparrow + 2NaOH\) (реакция Кольбе)
41) \(2CH_{3}CH_{2}COOK + 2H_{2}O \xrightarrow{эл. ток} CH_{3}CH_{2}CH_{2}CH_{3} + 2CO_{2} \uparrow + H_{2} \uparrow + 2KOH\)
42) \(2(CH_{3})_{2}CHCOOK + 2H_{2}O \xrightarrow{эл. ток} (CH_{3})_{2}CH-CH(CH_{3})_{2} + 2CO_{2} \uparrow + H_{2} \uparrow + 2KOH\)