schoolХимия
verifiedРешено AI
Решение задачи по химии: Расчет pH раствора KOH
help_outlineУсловие задачи
Реши задачу: Реши задачу
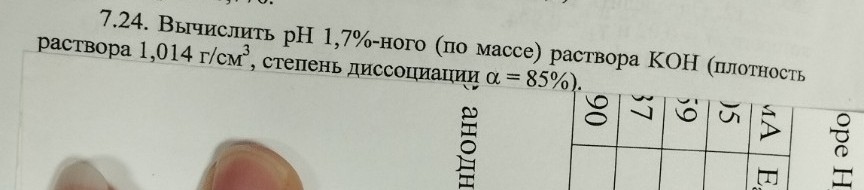
lightbulbКраткий ответ
Для расчета pH раствора KOH необходимо определить концентрацию гидроксид-ионов с учетом степени диссоциации и молярной концентрации. pH вычисляется через pOH.
Подробное решение
Задача 7.24
Дано:
\( \omega(KOH) = 1,7\% = 0,017 \)
\( \rho = 1,014 \text{ г/см}^3 = 1014 \text{ г/л} \)
\( \alpha = 85\% = 0,85 \)
\( M(KOH) = 39 + 16 + 1 = 56 \text{ г/моль} \)
Найти:
\( pH \) — ?
Решение:
1. Вычислим молярную концентрацию раствора \( C_M \). Для этого воспользуемся формулой связи массовой доли и молярности:
\[ C_M = \frac{10 \cdot \omega \cdot \rho}{M} \]
Подставим значения (используя плотность в г/см³ и массовую долю в процентах):
\[ C_M = \frac{10 \cdot 1,7 \cdot 1,014}{56} \approx 0,3078 \text{ моль/л} \]
2. Гидроксид калия \( KOH \) — сильное основание, диссоциирует по уравнению:
\( KOH \rightarrow K^+ + OH^- \)
Концентрация гидроксид-ионов \( [OH^-] \) с учетом степени диссоциации \( \alpha \) рассчитывается по формуле:
\[ [OH^-] = C_M \cdot \alpha \]
\[ [OH^-] = 0,3078 \cdot 0,85 \approx 0,2616 \text{ моль/л} \]
3. Найдем показатель \( pOH \):
\[ pOH = -\lg[OH^-] \]
\[ pOH = -\lg(0,2616) \approx 0,58 \]
4. Вычислим \( pH \) раствора, зная, что при стандартных условиях \( pH + pOH = 14 \):
\[ pH = 14 - pOH \]
\[ pH = 14 - 0,58 = 13,42 \]
Ответ: \( pH = 13,42 \).