schoolФизика
verifiedРешено AI
Решение задачи: Основы МКТ. Практическая работа №1
help_outlineУсловие задачи
Реши задачу: Решить пошагово каждое решение по формуле физика 10 класс
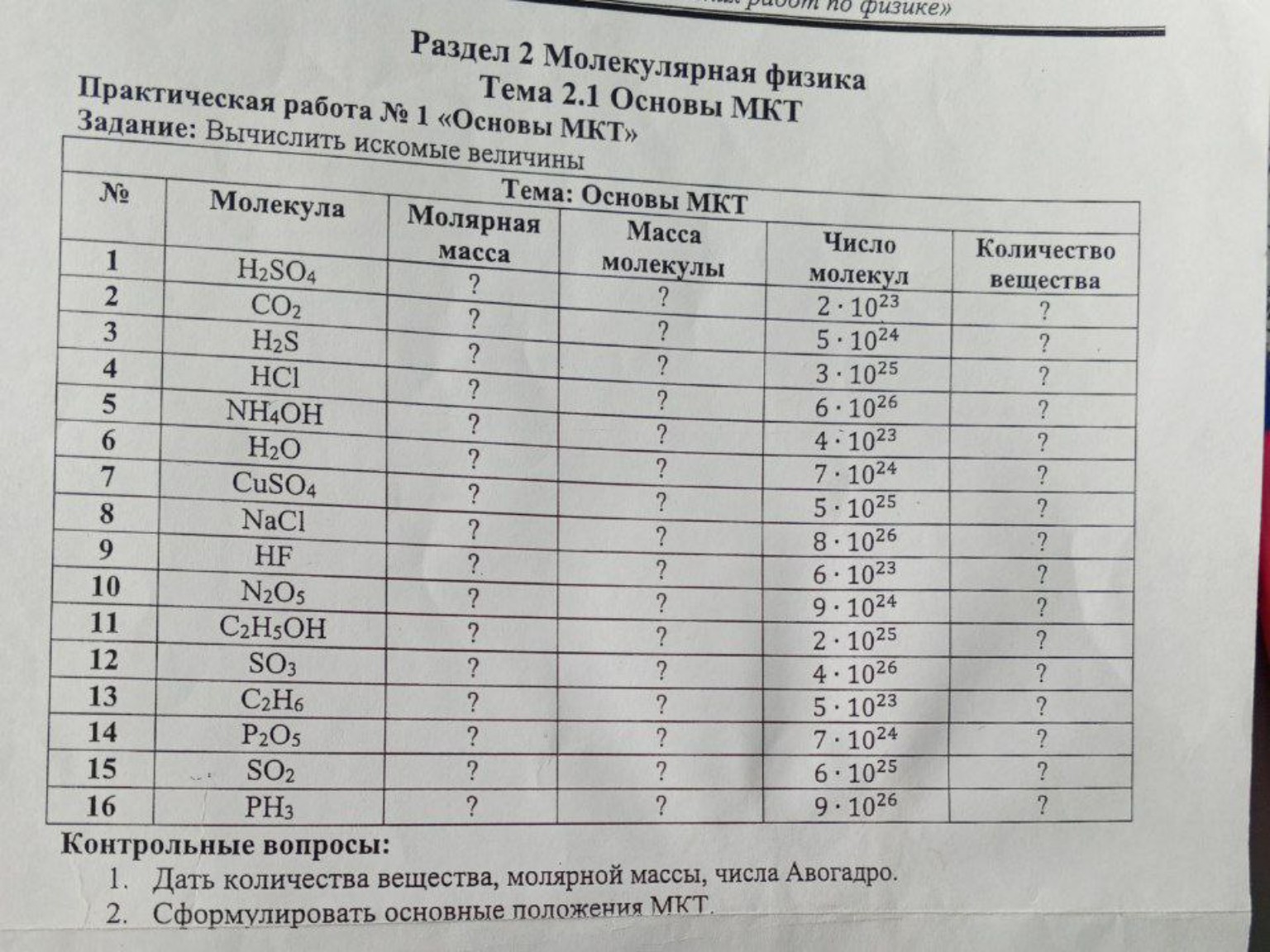
lightbulbКраткий ответ
Пошаговое решение задачи по физике 10 класс на тему 'Основы МКТ'. Рассмотрены формулы для расчета молярной массы, количества вещества и массы молекулы, с примером решения для H2SO4.
Подробное решение
Раздел 2 Молекулярная физика. Тема 2.1 Основы МКТ.
Практическая работа № 1 «Основы МКТ».
Для решения таблицы будем использовать следующие формулы:
1. Молярная масса \( M \) вычисляется по таблице Менделеева как сумма атомных масс элементов. Единица измерения — кг/моль (в СИ) или г/моль.
2. Количество вещества \( \nu \):
\[ \nu = \frac{N}{N_A} \]
где \( N_A = 6,02 \cdot 10^{23} \) моль\(^{-1}\) — постоянная Авогадро.
3. Масса одной молекулы \( m_0 \):
\[ m_0 = \frac{M}{N_A} \]
Решение для первой строки (№1 \( H_2SO_4 \)):
1. Молярная масса: \( M = 2 \cdot 1 + 32 + 4 \cdot 16 = 98 \) г/моль = \( 0,098 \) кг/моль.
2. Количество вещества: \( \nu = \frac{2 \cdot 10^{23}}{6,02 \cdot 10^{23}} \approx 0,33 \) моль.
3. Масса молекулы: \( m_0 = \frac{0,098}{6,02 \cdot 10^{23}} \approx 1,63 \cdot 10^{-25} \) кг.
Решение для второй строки (№2 \( CO_2 \)):
1. Молярная масса: \( M = 12 + 2 \cdot 16 = 44 \) г/моль = \( 0,044 \) кг/моль.
2. Количество вещества: \( \nu = \frac{5 \cdot 10^{24}}{6,02 \cdot 10^{23}} \approx 8,31 \) моль.
3. Масса молекулы: \( m_0 = \frac{0,044}{6,02 \cdot 10^{23}} \approx 7,31 \cdot 10^{-26} \) кг.
Решение для третьей строки (№3 \( H_2S \)):
1. Молярная масса: \( M = 2 \cdot 1 + 32 = 34 \) г/моль = \( 0,034 \) кг/моль.
2. Количество вещества: \( \nu = \frac{3 \cdot 10^{25}}{6,02 \cdot 10^{23}} \approx 49,83 \) моль.
3. Масса молекулы: \( m_0 = \frac{0,034}{6,02 \cdot 10^{23}} \approx 5,65 \cdot 10^{-26} \) кг.
Решение для четвертой строки (№4 \( HCl \)):
1. Молярная масса: \( M = 1 + 35,5 = 36,5 \) г/моль = \( 0,0365 \) кг/моль.
2. Количество вещества: \( \nu = \frac{6 \cdot 10^{26}}{6,02 \cdot 10^{23}} \approx 996,68 \) моль.
3. Масса молекулы: \( m_0 = \frac{0,0365}{6,02 \cdot 10^{23}} \approx 6,06 \cdot 10^{-26} \) кг.
Решение для пятой строки (№5 \( NH_4OH \)):
1. Молярная масса: \( M = 14 + 4 \cdot 1 + 16 + 1 = 35 \) г/моль = \( 0,035 \) кг/моль.
2. Количество вещества: \( \nu = \frac{4 \cdot 10^{23}}{6,02 \cdot 10^{23}} \approx 0,66 \) моль.
3. Масса молекулы: \( m_0 = \frac{0,035}{6,02 \cdot 10^{23}} \approx 5,81 \cdot 10^{-26} \) кг.
Решение для шестой строки (№6 \( H_2O \ )):
1. Молярная масса: \( M = 2 \cdot 1 + 16 = 18 \) г/моль = \( 0,018 \) кг/моль.
2. Количество вещества: \( \nu = \frac{7 \cdot 10^{24}}{6,02 \cdot 10^{23}} \approx 11,63 \) моль.
3. Масса молекулы: \( m_0 = \frac{0,018}{6,02 \cdot 10^{23}} \approx 2,99 \cdot 10^{-26} \) кг.
Ответы на контрольные вопросы:
1. Определения:
Количество вещества — это физическая величина, определяемая числом структурных частиц (атомов, молекул), содержащихся в данном теле.
Молярная масса — масса вещества, взятого в количестве одного моля.
Число Авогадро — число структурных единиц в одном моле любого вещества, \( N_A \approx 6,022 \cdot 10^{23} \) моль\(^{-1}\).
2. Основные положения МКТ:
— Все вещества состоят из мельчайших частиц (молекул, атомов), между которыми есть промежутки.
— Эти частицы находятся в непрерывном хаотическом (тепловом) движении.
— Частицы взаимодействуют друг с другом силами притяжения и отталкивания.