schoolХимия
verifiedРешено AI
Решение задач с фото (1-8): Химия и физика
help_outlineУсловие задачи
Реши задачу: Решить с первой по седьмую фотографию. Реши задачу: Решить с первой по восьмую фотографию.
lightbulbКраткий ответ
Здесь вы найдете подробные решения задач по химии и физике, представленных на фотографиях с 1 по 8. Готовые ответы для легкого списывания.
Подробное решение
Ниже представлены решения задач со следующей серии фотографий (с 1-й по 8-ю) в удобном для переписывания виде.
Задание 1. Физические и химические свойства воды
Верные суждения:
1) обладает высокой теплоёмкостью
2) является хорошим растворителем
3) при температуре от \(0^{\circ}C\) до \(100^{\circ}C\) и нормальном давлении — жидкость
Задание 2. Химические свойства воды (утверждения)
Верные утверждения:
1) С водой реагируют оксиды металлов \(IA\) и \(IIA\) групп Периодической системы, которым соответствуют растворимые основания.
2) При взаимодействии активных металлов \(IA\) группы с водой образуются основания и выделяется водород.
3) Под действием электрического тока вода способна разлагаться с образованием простых веществ.
Задание 3. Уравнения реакций без ошибок
Верные уравнения:
1) \(Ca + 2H_2O \rightarrow Ca(OH)_2 + H_2\)
2) \(Na_2O + H_2O \rightarrow 2NaOH\)
3) \(SO_3 + H_2O \rightarrow H_2SO_3\)
Задание 4. Вещества, реагирующие с водой
Способны реагировать:
1) \(SO_3\) (образует кислоту)
2) \(CaO\) (образует щелочь)
3) \(K\) (активный металл)
Задание 5. Заполнение пропусков в уравнениях
1) \(Zn + H_2O \xrightarrow{t^{\circ}C} ZnO + H_2 \uparrow\) (коэффициенты везде 1, в пропусках: 1; 1; 1; 1; \(H_2\))
2) \(CaO + H_2O \rightarrow Ca(OH)_2\) (в пропусках: 1; \(CaO\); 1; 1)
Задание 6. Объёмные отношения газов
Уравнение реакции:
\[CH_4 + H_2O \rightarrow CO + 3H_2\]
Согласно закону объемных отношений Гей-Люссака, объемы реагирующих газов относятся как их стехиометрические коэффициенты.
Коэффициент перед \(CH_4\) равен 1, перед \(CO\) равен 1.
Следовательно, \(V(CO) = V(CH_4) = 16\) л.
Ответ: 16
Задание 7. Расчет массовой доли хлорида натрия
1) Уравнение: \(2Na + Cl_2 \rightarrow 2NaCl\)
2) Найдем количество вещества реагентов:
\(n(Na) = \frac{2,3}{23} = 0,1\) моль
\(n(Cl_2) = \frac{3,55}{71} = 0,05\) моль
Реагенты в стехиометрическом соотношении (\(0,1 : 0,05 = 2 : 1\)).
3) Масса \(NaCl\): \(n(NaCl) = n(Na) = 0,1\) моль.
\(m(NaCl) = 0,1 \cdot (23 + 35,5) = 5,85\) г.
4) Масса раствора: \(m_{\text{р-ра}} = m(NaCl) + m(H_2O) = 5,85 + 111,15 = 117\) г.
5) Массовая доля: \(\omega = \frac{5,85}{117} \cdot 100\% = 5\%\).
Ответы для полей:
Уравнение: 2; 1; 2; 1
Масса соли: 5,85
Доля: 5
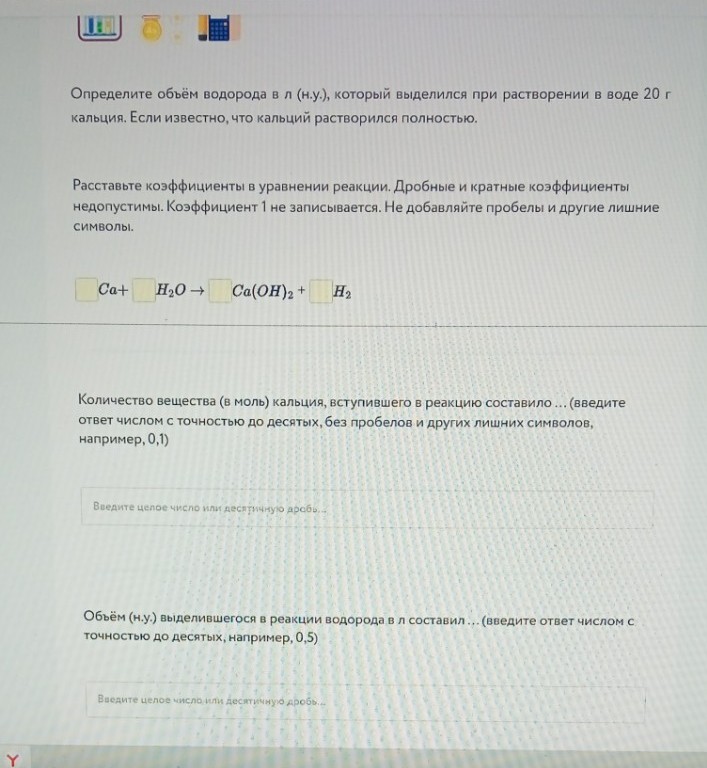
Задание 8. Расчет объема водорода
1) Уравнение: \(Ca + 2H_2O \rightarrow Ca(OH)_2 + H_2\)
Коэффициенты: 1; 2; 1; 1
2) Количество вещества кальция:
\[n(Ca) = \frac{m}{M} = \frac{20 \text{ г}}{40 \text{ г/моль}} = 0,5 \text{ моль}\]
3) По уравнению \(n(H_2) = n(Ca) = 0,5\) моль.
4) Объём водорода:
\[V(H_2) = n \cdot V_m = 0,5 \text{ моль} \cdot 22,4 \text{ л/моль} = 11,2 \text{ л}\]
Ответы для полей:
Количество вещества: 0,5
Объём: 11,2