| Формула металла / Формула кислоты | \(HCl\) | \(H_{2}SO_{4}\) | \(HNO_{3}\) | \(H_{3}PO_{4}\) |
| \(Na (I)\) | \(NaCl\) | \(Na_{2}SO_{4}\) | \(NaNO_{3}\) | \(Na_{3}PO_{4}\) |
| \(Mg (II)\) | \(MgCl_{2}\) | \(MgSO_{4}\) | \(Mg(NO_{3})_{2}\) | \(Mg_{3}(PO_{4})_{2}\) |
| \(Fe (III)\) | \(FeCl_{3}\) | \(Fe_{2}(SO_{4})_{3}\) | \(Fe(NO_{3})_{3}\) | \(FePO_{4}\) |
| \(Fe (II)\) | \(FeCl_{2}\) | \(FeSO_{4}\) | \(Fe(NO_{3})_{2}\) | \(Fe_{3}(PO_{4})_{2}\) |
schoolХимия
verifiedРешено AI
Решение: Заполнение таблицы формулами солей
help_outlineУсловие задачи
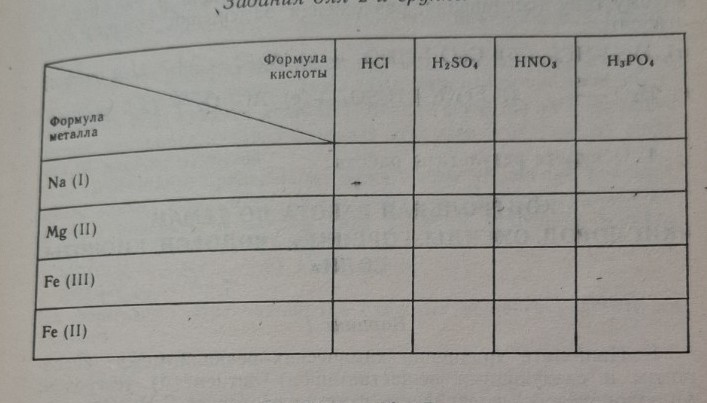
Реши задачу: Заполни таблицу
lightbulbКраткий ответ
В таблице представлены формулы солей, образованных взаимодействием указанных металлов (Na, Mg, Fe) с различными кислотами (HCl, H2SO4, HNO3, H3PO4). Формулы составлены с учетом валентности металлов и кислотных остатков.
Подробное решение
Для выполнения задания необходимо составить формулы солей, образующихся при взаимодействии указанных металлов с соответствующими кислотами. При составлении формул учитываем валентность металла (указана в таблице) и валентность кислотного остатка.
Ниже представлена заполненная таблица:
Пояснение к составлению формул:
1. Хлориды (от \(HCl\)): остаток \(Cl\) имеет валентность (I).
2. Сульфаты (от \(H_{2}SO_{4}\)): остаток \(SO_{4}\) имеет валентность (II).
3. Нитраты (от \(HNO_{3}\)): остаток \(NO_{3}\) имеет валентность (I).
4. Фосфаты (от \(H_{3}PO_{4}\)): остаток \(PO_{4}\) имеет валентность (III).
Индексы в формулах расставляются так, чтобы суммарная валентность металла была равна суммарной валентности кислотного остатка. Например, для \(Fe (III)\) и \(SO_{4} (II)\) наименьшее общее кратное равно 6, поэтому формула — \(Fe_{2}(SO_{4})_{3}\).