Задача:
Аэростаты, дирижабли – это разновидности воздухоплавательных аппаратов. Их передвижение и пребывание в воздушной среде обеспечивается за счёт лёгких газов (легче воздуха), которыми их наполняют. Чем меньше плотность газа, заполняющего летательный аппарат, тем меньше действующая на него сила тяжести и, следовательно, тем больше подъёмная сила:
\[F_{под} = g \cdot V \cdot (\rho_{возд.} - \rho_{газа})\]где \(\rho\) - плотность (\(кг/м^3\)), \(g\) - ускорение свободного падения (\(g = 9,8 Н/кг\)), \(V\) - объём газа (\(м^3\)).
Водород в 14,5 раз легче воздуха, подъёмная сила летательного аппарата на водороде высока. Кажется, что это идеальный газ для воздухоплавания, но из-за высокой взрывоопасности, вместо водорода в настоящее время используют гелий.
Рассчитайте абсолютную плотность водорода и воздуха. Определите объём водорода (при н.у.), которым необходимо наполнить дирижабль, чтобы подъёмная сила составила 28,9 кН. Какой объём кислорода вступит в реакцию с таким объёмом водорода (н.у.)?
Проведите необходимые расчёты (промежуточные вычисления округляйте до сотых), ответьте на вопросы.
Решение:
1. Расчёт абсолютной плотности воздуха и водорода при нормальных условиях (н.у.).
Для расчёта плотности газов при нормальных условиях (н.у.) мы можем использовать молярные массы газов и молярный объём идеального газа при н.у., который равен 22,4 \(л/моль\) или 0,0224 \(м^3/моль\).
Плотность воздуха:
Средняя молярная масса воздуха составляет примерно 29 \(г/моль\) или 0,029 \(кг/моль\).
\[\rho_{возд.} = \frac{M_{возд.}}{V_m}\]где \(M_{возд.}\) - молярная масса воздуха, \(V_m\) - молярный объём.
\[\rho_{возд.} = \frac{0,029 \text{ кг/моль}}{0,0224 \text{ м}^3/\text{моль}} \approx 1,29 \text{ кг/м}^3\]Округляем до сотых: \(\rho_{возд.} \approx 1,29 \text{ кг/м}^3\).
Плотность водорода:
Молярная масса водорода (\(H_2\)) составляет примерно 2 \(г/моль\) или 0,002 \(кг/моль\).
\[\rho_{H_2} = \frac{M_{H_2}}{V_m}\] \[\rho_{H_2} = \frac{0,002 \text{ кг/моль}}{0,0224 \text{ м}^3/\text{моль}} \approx 0,089 \text{ кг/м}^3\]Округляем до сотых: \(\rho_{H_2} \approx 0,09 \text{ кг/м}^3\).
Проверим условие, что водород в 14,5 раз легче воздуха:
\[\frac{\rho_{возд.}}{\rho_{H_2}} = \frac{1,29}{0,09} \approx 14,33\]Это близко к 14,5, что подтверждает наши расчёты.
2. Определение объёма водорода, необходимого для создания подъёмной силы 28,9 кН.
Дано: \(F_{под} = 28,9 \text{ кН} = 28900 \text{ Н}\), \(g = 9,8 \text{ Н/кг}\).
Используем формулу для подъёмной силы:
\[F_{под} = g \cdot V \cdot (\rho_{возд.} - \rho_{H_2})\]Выразим объём \(V\):
\[V = \frac{F_{под}}{g \cdot (\rho_{возд.} - \rho_{H_2})}\]Подставим значения:
\[V = \frac{28900 \text{ Н}}{9,8 \text{ Н/кг} \cdot (1,29 \text{ кг/м}^3 - 0,09 \text{ кг/м}^3)}\] \[V = \frac{28900}{9,8 \cdot 1,20}\] \[V = \frac{28900}{11,76} \approx 2457,48 \text{ м}^3\]Округляем до сотых: \(V \approx 2457,48 \text{ м}^3\).
Ответ на первый вопрос:
Объём (в \(м^3\)) водорода, которым необходимо заполнить дирижабль, равен ... (ответ запишите числом с точностью до сотых, например, 100,23)
2457,48
3. Какой объём кислорода вступит в реакцию с таким объёмом водорода (н.у.)?
Реакция водорода с кислородом с образованием воды:
\[2H_2 + O_2 \rightarrow 2H_2O\]Согласно закону Авогадро, при одинаковых условиях (температура и давление) объёмы реагирующих газов относятся как их стехиометрические коэффициенты в уравнении реакции.
Из уравнения видно, что 2 объёма водорода реагируют с 1 объёмом кислорода.
Объём водорода \(V_{H_2} = 2457,48 \text{ м}^3\).
Объём кислорода \(V_{O_2}\) будет в 2 раза меньше объёма водорода:
\[V_{O_2} = \frac{V_{H_2}}{2}\] \[V_{O_2} = \frac{2457,48 \text{ м}^3}{2} = 1228,74 \text{ м}^3\]Округляем до сотых: \(V_{O_2} \approx 1228,74 \text{ м}^3\).
Ответ на второй вопрос:
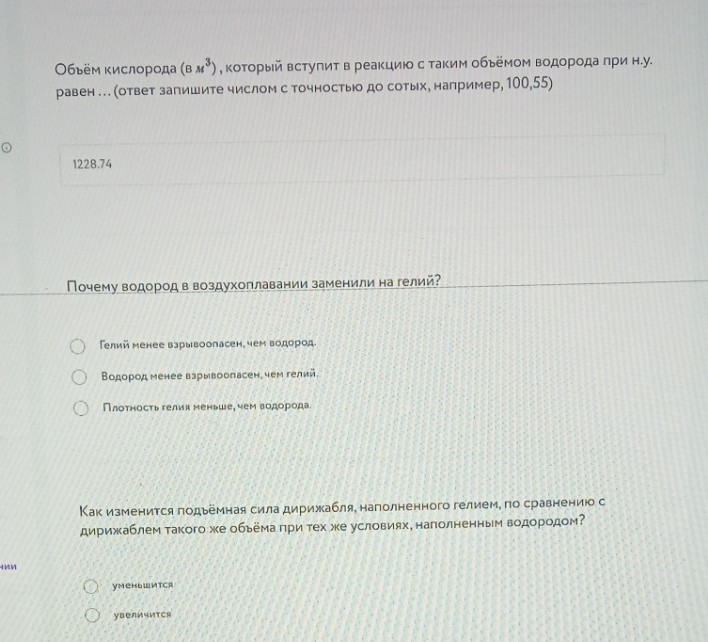
Объём кислорода (в \(м^3\)), который вступит в реакцию с таким объёмом водорода при н.у. равен ... (ответ запишите числом с точностью до сотых, например, 100,55)
1228,74
4. Почему водород в воздухоплавании заменили на гелий?
Из предложенных вариантов:
- Гелий менее взрывоопасен, чем водород.
- Водород менее взрывоопасен, чем гелий.
- Плотность гелия меньше, чем водорода.
В тексте задачи прямо указано: "из-за высокой взрывоопасности, вместо водорода в настоящее время используют гелий". Водород очень легко воспламеняется и образует взрывоопасные смеси с воздухом, что приводило к катастрофам (например, гибель дирижабля "Гинденбург"). Гелий же является инертным газом и не горит.
Правильный ответ: Гелий менее взрывоопасен, чем водород.
5. Как изменится подъёмная сила дирижабля, наполненного гелием, по сравнению с дирижаблем такого же объёма при тех же условиях, наполненным водородом?
Подъёмная сила определяется формулой: \(F_{под} = g \cdot V \cdot (\rho_{возд.} - \rho_{газа})\).
Для водорода: \(F_{под, H_2} = g \cdot V \cdot (\rho_{возд.} - \rho_{H_2})\).
Для гелия: \(F_{под, He} = g \cdot V \cdot (\rho_{возд.} - \rho_{He})\).
Молярная масса гелия (\(He\)) составляет примерно 4 \(г/моль\) или 0,004 \(кг/моль\).
Плотность гелия при н.у.:
\[\rho_{He} = \frac{M_{He}}{V_m} = \frac{0,004 \text{ кг/моль}}{0,0224 \text{ м}^3/\text{моль}} \approx 0,178 \text{ кг/м}^3\]Округляем до сотых: \(\rho_{He} \approx 0,18 \text{ кг/м}^3\).
Сравним плотности:
\(\rho_{H_2} \approx 0,09 \text{ кг/м}^3\)
\(\rho_{He} \approx 0,18 \text{ кг/м}^3\)
Мы видим, что плотность гелия (\(0,18 \text{ кг/м}^3\)) больше плотности водорода (\(0,09 \text{ кг/м}^3\)).
Поскольку \(\rho_{He} > \rho_{H_2}\), то разность \((\rho_{возд.} - \rho_{He})\) будет меньше, чем \((\rho_{возд.} - \rho_{H_2})\).
Следовательно, подъёмная сила дирижабля, наполненного гелием, будет меньше, чем у дирижабля, наполненного водородом, при том же объёме и условиях.
Правильный ответ: уменьшится.