Задача 1
Какой объём будет занимать газ при температуре 77°C, если при 27°C его объём равен 0,006 м3, при постоянном давлении.
| Дано: | СИ: | Решение: |
|
\(T_1 = 27^\circ C\) \(V_1 = 0,006 \text{ м}^3\) \(T_2 = 77^\circ C\) \(P = \text{const}\) |
\(T_1 = 27 + 273 = 300 \text{ К}\) \(V_1 = 0,006 \text{ м}^3\) \(T_2 = 77 + 273 = 350 \text{ К}\) |
Поскольку давление постоянно, используем закон Гей-Люссака: \[\frac{V_1}{T_1} = \frac{V_2}{T_2}\]Выразим \(V_2\): \[V_2 = \frac{V_1 \cdot T_2}{T_1}\]Подставим значения: \[V_2 = \frac{0,006 \text{ м}^3 \cdot 350 \text{ К}}{300 \text{ К}}\] \[V_2 = \frac{2,1}{300} \text{ м}^3\] \[V_2 = 0,007 \text{ м}^3\] |
| Найти: | Ответ: | |
| \(V_2 - ?\) | \(V_2 = 0,007 \text{ м}^3\) | |
Задача 2
Газ при давлении 200 кПа и температуре 17°C имеет объем 5 л. Чему равен объем (л) этой массы газа при давлении 100 кПа и температуре -3°C?
| Дано: | СИ: | Решение: |
|
\(P_1 = 200 \text{ кПа}\) \(T_1 = 17^\circ C\) \(V_1 = 5 \text{ л}\) \(P_2 = 100 \text{ кПа}\) \(T_2 = -3^\circ C\) |
\(P_1 = 200 \cdot 10^3 \text{ Па}\) \(T_1 = 17 + 273 = 290 \text{ К}\) \(V_1 = 5 \cdot 10^{-3} \text{ м}^3\) \(P_2 = 100 \cdot 10^3 \text{ Па}\) \(T_2 = -3 + 273 = 270 \text{ К}\) |
Используем объединенный газовый закон (уравнение Клапейрона): \[\frac{P_1 V_1}{T_1} = \frac{P_2 V_2}{T_2}\]Выразим \(V_2\): \[V_2 = \frac{P_1 V_1 T_2}{P_2 T_1}\]Подставим значения: \[V_2 = \frac{200 \cdot 10^3 \text{ Па} \cdot 5 \cdot 10^{-3} \text{ м}^3 \cdot 270 \text{ К}}{100 \cdot 10^3 \text{ Па} \cdot 290 \text{ К}}\] \[V_2 = \frac{200 \cdot 5 \cdot 270}{100 \cdot 290} \cdot 10^{-3} \text{ м}^3\] \[V_2 = \frac{270000}{29000} \cdot 10^{-3} \text{ м}^3\] \[V_2 \approx 9,31 \cdot 10^{-3} \text{ м}^3\]Переведем в литры: \[V_2 = 9,31 \text{ л}\] |
| Найти: | Ответ: | |
| \(V_2 - ?\) | \(V_2 \approx 9,31 \text{ л}\) | |
Задача 3
В баллоне вместимостью 25,6 л находится 1,04 кг азота при давлении 3,55 МПа. Определить температуру газа.
| Дано: | СИ: | Решение: |
|
\(V = 25,6 \text{ л}\) \(m = 1,04 \text{ кг}\) \(P = 3,55 \text{ МПа}\) \(R = 8,31 \frac{\text{Дж}}{\text{моль} \cdot \text{К}}\) (универсальная газовая постоянная) \(M(\text{N}_2) = 28 \frac{\text{г}}{\text{моль}}\) (молярная масса азота) |
\(V = 25,6 \cdot 10^{-3} \text{ м}^3\) \(m = 1,04 \text{ кг}\) \(P = 3,55 \cdot 10^6 \text{ Па}\) \(M(\text{N}_2) = 0,028 \frac{\text{кг}}{\text{моль}}\) |
Используем уравнение Менделеева-Клапейрона: \[PV = \frac{m}{M}RT\]Выразим температуру \(T\): \[T = \frac{PV M}{mR}\]Подставим значения: \[T = \frac{3,55 \cdot 10^6 \text{ Па} \cdot 25,6 \cdot 10^{-3} \text{ м}^3 \cdot 0,028 \frac{\text{кг}}{\text{моль}}}{1,04 \text{ кг} \cdot 8,31 \frac{\text{Дж}}{\text{моль} \cdot \text{К}}}\] \[T = \frac{3550000 \cdot 0,0256 \cdot 0,028}{1,04 \cdot 8,31} \text{ К}\] \[T = \frac{2540,8}{8,6424} \text{ К}\] \[T \approx 294,0 \text{ К}\]Переведем в градусы Цельсия: \[T^\circ C = T - 273\] \[T^\circ C = 294,0 - 273 = 21^\circ C\] |
| Найти: | Ответ: | |
| \(T - ?\) | \(T \approx 294,0 \text{ К}\) или \(T \approx 21^\circ C\) | |
Задача 4
Определите массу водорода, находящегося в баллоне вместимостью 20 л под давлением 830 кПа при температуре 17°C.
| Дано: | СИ: | Решение: |
|
\(V = 20 \text{ л}\) \(P = 830 \text{ кПа}\) \(T = 17^\circ C\) \(R = 8,31 \frac{\text{Дж}}{\text{моль} \cdot \text{К}}\) \(M(\text{H}_2) = 2 \frac{\text{г}}{\text{моль}}\) (молярная масса водорода) |
\(V = 20 \cdot 10^{-3} \text{ м}^3\) \(P = 830 \cdot 10^3 \text{ Па}\) \(T = 17 + 273 = 290 \text{ К}\) \(M(\text{H}_2) = 0,002 \frac{\text{кг}}{\text{моль}}\) |
Используем уравнение Менделеева-Клапейрона: \[PV = \frac{m}{M}RT\]Выразим массу \(m\): \[m = \frac{PV M}{RT}\]Подставим значения: \[m = \frac{830 \cdot 10^3 \text{ Па} \cdot 20 \cdot 10^{-3} \text{ м}^3 \cdot 0,002 \frac{\text{кг}}{\text{моль}}}{8,31 \frac{\text{Дж}}{\text{моль} \cdot \text{К}} \cdot 290 \text{ К}}\] \[m = \frac{830000 \cdot 0,02 \cdot 0,002}{8,31 \cdot 290} \text{ кг}\] \[m = \frac{33,2}{2409,9} \text{ кг}\] \[m \approx 0,01377 \text{ кг}\]Переведем в граммы: \[m \approx 13,77 \text{ г}\] |
| Найти: | Ответ: | |
| \(m - ?\) | \(m \approx 0,01377 \text{ кг}\) или \(m \approx 13,77 \text{ г}\) | |
Задача 5
Газ находится в сосуде объёмом 2 л, имеет давление 3 атм. Какое давление будет у газа, если объём сосуда уменьшить до 1 л, при условии, что температура остаётся постоянной?
| Дано: | СИ: | Решение: |
|
\(V_1 = 2 \text{ л}\) \(P_1 = 3 \text{ атм}\) \(V_2 = 1 \text{ л}\) \(T = \text{const}\) |
\(V_1 = 2 \cdot 10^{-3} \text{ м}^3\) \(P_1 = 3 \cdot 101325 \text{ Па} = 303975 \text{ Па}\) \(V_2 = 1 \cdot 10^{-3} \text{ м}^3\) |
Поскольку температура постоянна, используем закон Бойля-Мариотта: \[P_1 V_1 = P_2 V_2\]Выразим \(P_2\): \[P_2 = \frac{P_1 V_1}{V_2}\]Подставим значения: \[P_2 = \frac{3 \text{ атм} \cdot 2 \text{ л}}{1 \text{ л}}\] \[P_2 = 6 \text{ атм}\]Если требуется в Паскалях: \[P_2 = 6 \cdot 101325 \text{ Па} = 607950 \text{ Па}\] |
| Найти: | Ответ: | |
| \(P_2 - ?\) | \(P_2 = 6 \text{ атм}\) (или \(607,95 \text{ кПа}\)) | |
Задача 6
Идеальный газ находится в герметичном сосуде, его температуру увеличили в 2 раза. Во сколько раз изменилось давление газа?
| Дано: | СИ: | Решение: |
|
\(V = \text{const}\) (герметичный сосуд) \(T_2 = 2 T_1\) |
Не требуется перевода в СИ, так как ищем отношение. |
Поскольку объем газа постоянен, используем закон Шарля: \[\frac{P_1}{T_1} = \frac{P_2}{T_2}\]Выразим отношение давлений \(\frac{P_2}{P_1}\): \[\frac{P_2}{P_1} = \frac{T_2}{T_1}\]Подставим \(T_2 = 2 T_1\): \[\frac{P_2}{P_1} = \frac{2 T_1}{T_1}\] \[\frac{P_2}{P_1} = 2\]Давление газа увеличилось в 2 раза. |
| Найти: | Ответ: | |
| \(\frac{P_2}{P_1} - ?\) | Давление газа увеличилось в 2 раза. | |
Задача 7
20-литровый баллон содержит 6 атмосфер газа при температуре 27°C. Каким было бы давление газа, если бы его нагрели до 77°C?
| Дано: | СИ: | Решение: |
|
\(V = 20 \text{ л}\) (объем баллона, \(\text{const}\)) \(P_1 = 6 \text{ атм}\) \(T_1 = 27^\circ C\) \(T_2 = 77^\circ C\) |
\(P_1 = 6 \cdot 101325 \text{ Па} = 607950 \text{ Па}\) \(T_1 = 27 + 273 = 300 \text{ К}\) \(T_2 = 77 + 273 = 350 \text{ К}\) |
<
Решите свою задачу прямо сейчасВведите текст задачи или загрузите фото — получите ответ мгновенно Бонус получен!
+20 ₽
Добавлено на ваш баланс
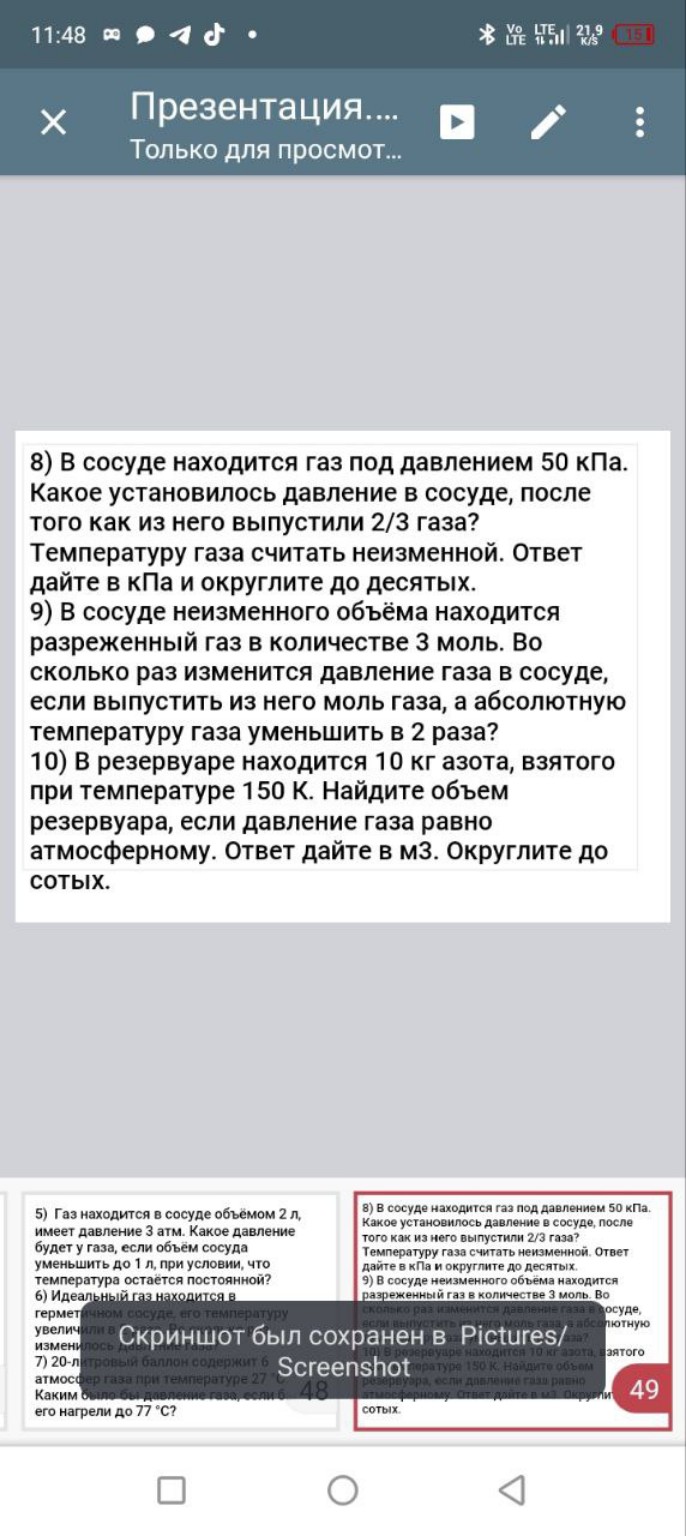
|