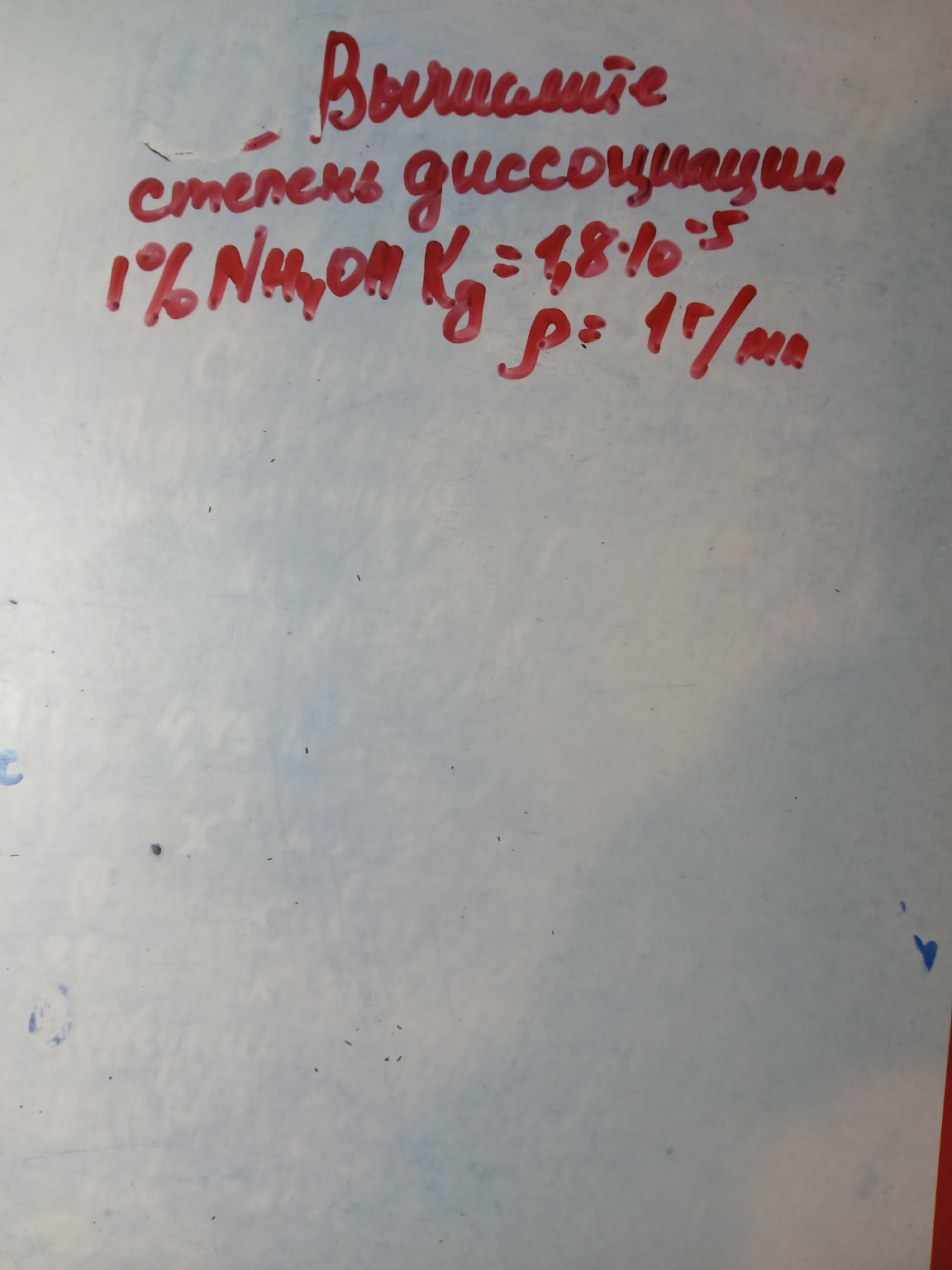help_outline Условие задачи
Нажмите для увеличения
lightbulb Краткий ответ
Для расчета степени диссоциации NH4OH необходимо найти молярную концентрацию раствора, используя заданные Kд и плотность. Представлено подробное решение задачи с формулами.
На изображении написана задача:
"Вычислите степень диссоциации 1% \(NH_4OH\), \(K_д = 1,8 \cdot 10^{-5}\), \(\rho = 1 \text{ г/мл}\)"
Давайте решим эту задачу. Гидроксид аммония \(NH_4OH\) - это слабое основание. Для вычисления степени диссоциации нам сначала нужно найти молярную концентрацию раствора.
Решение задачи
1. Найдем молярную массу \(NH_4OH\)
Молярная масса \(NH_4OH\) (или \(NH_3 \cdot H_2O\)):
\(M(N) = 14\) г/моль
\(M(H) = 1\) г/моль
\(M(O) = 16\) г/моль
\(M(NH_4OH) = M(N) + 5 \cdot M(H) + M(O) = 14 + 5 \cdot 1 + 16 = 35\) г/моль.
2. Найдем молярную концентрацию \(C_0\) раствора
Нам дан 1% раствор \(NH_4OH\) и плотность \(\rho = 1\) г/мл.
Это означает, что в 100 г раствора содержится 1 г \(NH_4OH\).
Масса раствора: \(m_{раствора} = 100\) г.
Масса \(NH_4OH\): \(m_{NH_4OH} = 1\) г.
Объем раствора:
\[V_{раствора} = \frac{m_{раствора}}{\rho} = \frac{100 \text{ г}}{1 \text{ г/мл}} = 100 \text{ мл} = 0,1 \text{ л}\]
Количество молей \(NH_4OH\):
\[n_{NH_4OH} = \frac{m_{NH_4OH}}{M_{NH_4OH}} = \frac{1 \text{ г}}{35 \text{ г/моль}} \approx 0,02857 \text{ моль}\]
Молярная концентрация \(C_0\):
\[C_0 = \frac{n_{NH_4OH}}{V_{раствора}} = \frac{0,02857 \text{ моль}}{0,1 \text{ л}} \approx 0,2857 \text{ М}\]
3. Запишем уравнение диссоциации \(NH_4OH\) и выражение для константы диссоциации
Уравнение диссоциации:
\[NH_4OH \rightleftharpoons NH_4^+ + OH^-\]
Выражение для константы диссоциации \(K_д\):
\[K_д = \frac{[NH_4^+][OH^-]}{[NH_4OH]}\]
4. Обозначим равновесные концентрации
Пусть \(\alpha\) - степень диссоциации.
Тогда равновесные концентрации будут:
* \([NH_4OH] = C_0(1 - \alpha)\)
* \([NH_4^+] = C_0\alpha\)
* \([OH^-] = C_0\alpha\)
Подставим эти значения в выражение для \(K_д\):
\[K_д = \frac{(C_0\alpha)(C_0\alpha)}{C_0(1 - \alpha)} = \frac{C_0\alpha^2}{1 - \alpha}\]
5. Решим уравнение для \(\alpha\)
Нам дано \(K_д = 1,8 \cdot 10^{-5}\) и мы нашли \(C_0 \approx 0,2857\) М.
\[1,8 \cdot 10^{-5} = \frac{0,2857 \cdot \alpha^2}{1 - \alpha}\]
Поскольку \(NH_4OH\) - слабое основание, степень диссоциации \(\alpha\) будет мала. Можно сделать допущение, что \(1 - \alpha \approx 1\).
\[1,8 \cdot 10^{-5} \approx \frac{0,2857 \cdot \alpha^2}{1}\]
\[\alpha^2 = \frac{1,8 \cdot 10^{-5}}{0,2857}\]
\[\alpha^2 \approx 6,299 \cdot 10^{-5}\]
\[\alpha = \sqrt{6,299 \cdot 10^{-5}}\]
\[\alpha \approx 0,007937\]
6. Проверим допущение
\(\alpha \approx 0,007937\). В процентах это \(0,007937 \cdot 100\% = 0,7937\%\).
Поскольку \(0,7937\% < 5\%\), наше допущение \(1 - \alpha \approx 1\) было верным.
Ответ
Степень диссоциации 1% раствора \(NH_4OH\) составляет:
\[\alpha \approx 0,00794 \text{ или } 0,794\%\]