schoolХимия
verifiedРешено AI
Оксиды серы. Серная кислота, физические и химические свойства, применение.
help_outlineУсловие задачи
lightbulbКраткий ответ
Решение задачи на соответствие свойств оксидов серы SO2 и SO3. Определены физические свойства и их соответствия для каждого оксида, образуя слово.
Подробное решение
Хорошо, давайте решим эти задания по химии.
Заголовок: Оксиды серы. Серная кислота, физические и химические свойства, применение.
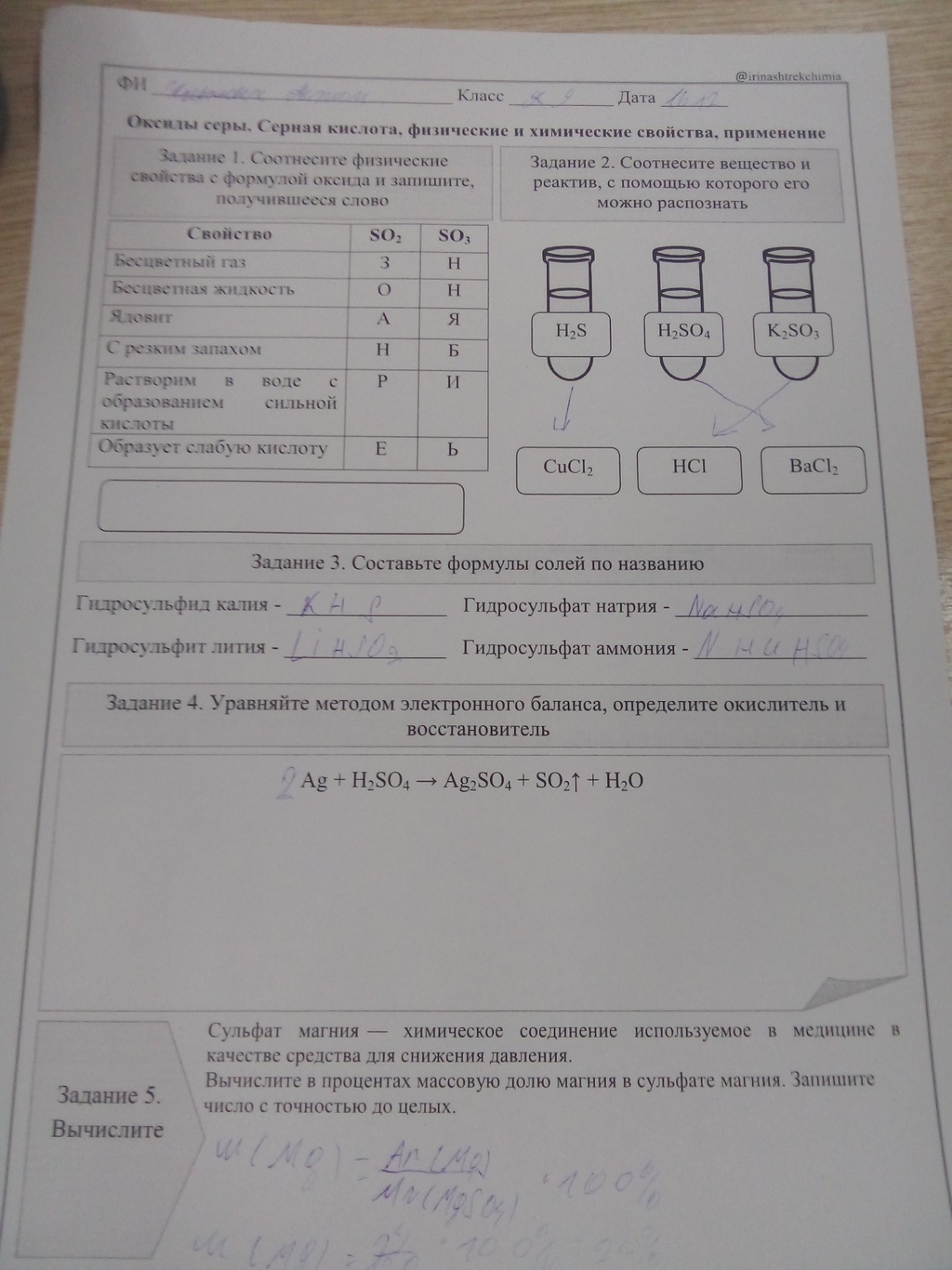
Задание 1. Соотнесите физические свойства с формулой оксида и запишите, получившееся слово.
| Свойство | SO2 | SO3 |
| :-------------------------------- | :------- | :------- |
| Бесцветный газ | З | Н |
| Бесцветная жидкость | О | Н |
| Ядовит | А | Я |
| С резким запахом | Н | Б |
| Растворим в воде с образованием сильной кислоты | Р | И |
| Образует слабую кислоту | Е | Ь |
Решение:
* SO2 (сернистый газ)
* Бесцветный газ - З
* Ядовит - А
* С резким запахом - Н
* Растворим в воде с образованием слабой кислоты (сернистой кислоты) - Е
* SO3 (серный ангидрид)
* Бесцветная жидкость (при комнатной температуре может быть и твердым, но чаще указывается как жидкость) - О
* Растворим в воде с образованием сильной кислоты (серной кислоты) - И
Сопоставим свойства:
* SO2:
* Бесцветный газ - З
* Ядовит - А
* С резким запахом - Н
* Образует слабую кислоту - Е
* SO3:
* Бесцветная жидкость - О
* Растворим в воде с образованием сильной кислоты - И
Получившееся слово (для SO2): З А Н Е
Получившееся слово (для SO3): О И
Если нужно составить слово из букв, соответствующих свойствам SO2, то это будет "ЗАНЕ".
Если нужно составить слово из букв, соответствующих свойствам SO3, то это будет "ОИ".
Обычно в таких заданиях подразумевается одно слово, составленное из букв, соответствующих одному веществу. Вероятно, здесь нужно было составить слово из свойств SO2.
Слово: ЗАНЕ
Задание 2. Соотнесите вещество и реактив, с помощью которого его можно распознать.
* H2S (сероводород)
* H2SO4 (серная кислота)
* K2SO3 (сульфит калия)
Реактивы:
* CuCl2 (хлорид меди(II))
* HCl (соляная кислота)
* BaCl2 (хлорид бария)
Решение:
* H2S (сероводород) можно распознать с помощью солей тяжелых металлов, например, CuCl2. При взаимодействии образуется черный осадок сульфида меди(II):
\[\text{H}_2\text{S} + \text{CuCl}_2 \rightarrow \text{CuS}\downarrow + 2\text{HCl}\]
Следовательно, H2S —> CuCl2.
* H2SO4 (серную кислоту) можно распознать с помощью солей бария, например, BaCl2. При взаимодействии образуется белый осадок сульфата бария:
\[\text{H}_2\text{SO}_4 + \text{BaCl}_2 \rightarrow \text{BaSO}_4\downarrow + 2\text{HCl}\]
Следовательно, H2}SO4 —> BaCl2.
* K2SO3 (сульфит калия) можно распознать с помощью сильных кислот, например, HCl. При взаимодействии выделяется сернистый газ (SO2) с резким запахом:
\[\text{K}_2\text{SO}_3 + 2\text{HCl} \rightarrow 2\text{KCl} + \text{SO}_2\uparrow + \text{H}_2\text{O}\]
Следовательно, K2SO3 —> HCl.
Задание 3. Составьте формулы солей по названию.
* Гидросульфид калия - \( \text{KHS} \)
* Гидросульфат натрия - \( \text{NaHSO}_4 \)
* Гидросульфит лития - \( \text{LiHSO}_3 \)
* Гидросульфат аммония - \( \text{NH}_4\text{HSO}_4 \)
Задание 4. Уравняйте методом электронного баланса, определите окислитель и восстановитель.
\[\text{Ag} + \text{H}_2\text{SO}_4 \rightarrow \text{Ag}_2\text{SO}_4 + \text{SO}_2\uparrow + \text{H}_2\text{O}\]
Решение:
1. Определим степени окисления элементов:
* В Ag: \( \text{Ag}^0 \)
* В H2SO4: \( \text{H}^{+1}_2\text{S}^{+6}\text{O}^{-2}_4 \)
* В Ag2SO4: \( \text{Ag}^{+1}_2\text{S}^{+6}\text{O}^{-2}_4 \)
* В SO2: \( \text{S}^{+4}\text{O}^{-2}_2 \)
* В H2O: \( \text{H}^{+1}_2\text{O}^{-2} \)
2. Найдем элементы, изменившие степень окисления:
* Серебро: \( \text{Ag}^0 \rightarrow \text{Ag}^{+1} \)
* Сера: \( \text{S}^{+6} \rightarrow \text{S}^{+4} \)
3. Составим электронный баланс:
* Окисление (отдача электронов):
\( \text{Ag}^0 - 1\text{e}^- \rightarrow \text{Ag}^{+1} \) | 2 (коэффициент)
* Восстановление (прием электронов):
\( \text{S}^{+6} + 2\text{e}^- \rightarrow \text{S}^{+4} \) | 1 (коэффициент)
4. Наименьшее общее кратное для 1 и 2 равно 2. Коэффициенты: для Ag — 2, для S — 1.
5. Расставим коэффициенты в уравнении:
\[2\text{Ag} + \text{H}_2\text{SO}_4 \rightarrow \text{Ag}_2\text{SO}_4 + \text{SO}_2\uparrow + \text{H}_2\text{O}\]
Теперь уравняем серу. В правой части: 1 атом S в Ag2SO4 и 1 атом S в SO2, итого 2 атома S. Значит, перед H2SO4 в левой части нужно поставить 2.
\[2\text{Ag} + 2\text{H}_2\text{SO}_4 \rightarrow \text{Ag}_2\text{SO}_4 + \text{SO}_2\uparrow + \text{H}_2\text{O}\]
Уравняем водород. В левой части: \( 2 \times 2 = 4 \) атома H. В правой части: 2 атома H в H2O. Значит, перед H2O нужно поставить 2.
\[2\text{Ag} + 2\text{H}_2\text{SO}_4 \rightarrow \text{Ag}_2\text{SO}_4 + \text{SO}_2\uparrow + 2\text{H}_2\text{O}\]
Проверим кислород. В левой части: \( 2 \times 4 = 8 \) атомов O. В правой части: 4 атома O в Ag2SO4, 2 атома O в SO2, \( 2 \times 1 = 2 \) атома O в H2O. Итого \( 4 + 2 + 2 = 8 \) атомов O. Кислород уравнен.
Окончательное уравнение:
\[2\text{Ag} + 2\text{H}_2\text{SO}_4 \rightarrow \text{Ag}_2\text{SO}_4 + \text{SO}_2\uparrow + 2\text{H}_2\text{O}\]
6. Определим окислитель и восстановитель:
* \( \text{Ag}^0 \) отдает электроны, поэтому Ag является восстановителем.
* \( \text{S}^{+6} \) в H2SO4 принимает электроны, поэтому H2SO4 является окислителем.
Задание 5. Вычислите в процентах массовую долю магния в сульфате магния. Запишите число с точностью до целых.
Сульфат магния — химическое соединение, используемое в медицине в качестве средства для снижения давления.
Решение:
1. Запишем формулу сульфата магния. Магний (Mg) имеет валентность II, сульфат-ион (SO4) имеет валентность II. Значит, формула сульфата магния — \( \text{MgSO}_4 \).
2. Найдем относительные атомные массы элементов (округлим до целых):
* \( \text{Ar}(\text{Mg}) = 24 \)
* \( \text{Ar}(\text{S}) = 32 \)
* \( \text{Ar}(\text{O}) = 16 \)
3. Вычислим относительную молекулярную массу сульфата магния \( \text{Mr}(\text{MgSO}_4) \):
\[ \text{Mr}(\text{MgSO}_4) = \text{Ar}(\text{Mg}) + \text{Ar}(\text{S}) + 4 \times \text{Ar}(\text{O}) \]
\[ \text{Mr}(\text{MgSO}_4) = 24 + 32 + 4 \times 16 \]
\[ \text{Mr}(\text{MgSO}_4) = 24 + 32 + 64 \]
\[ \text{Mr}(\text{MgSO}_4) = 120 \]
4. Вычислим массовую долю магния \( \omega(\text{Mg}) \) в сульфате магния:
\[ \omega(\text{Mg}) = \frac{\text{Ar}(\text{Mg})}{\text{Mr}(\text{MgSO}_4)} \times 100\% \]
\[ \omega(\text{Mg}) = \frac{24}{120} \times 100\% \]
\[ \omega(\text{Mg}) = 0.2 \times 100\% \]
\[ \omega(\text{Mg}) = 20\% \]
Ответ: Массовая доля магния в сульфате магния составляет 20%.