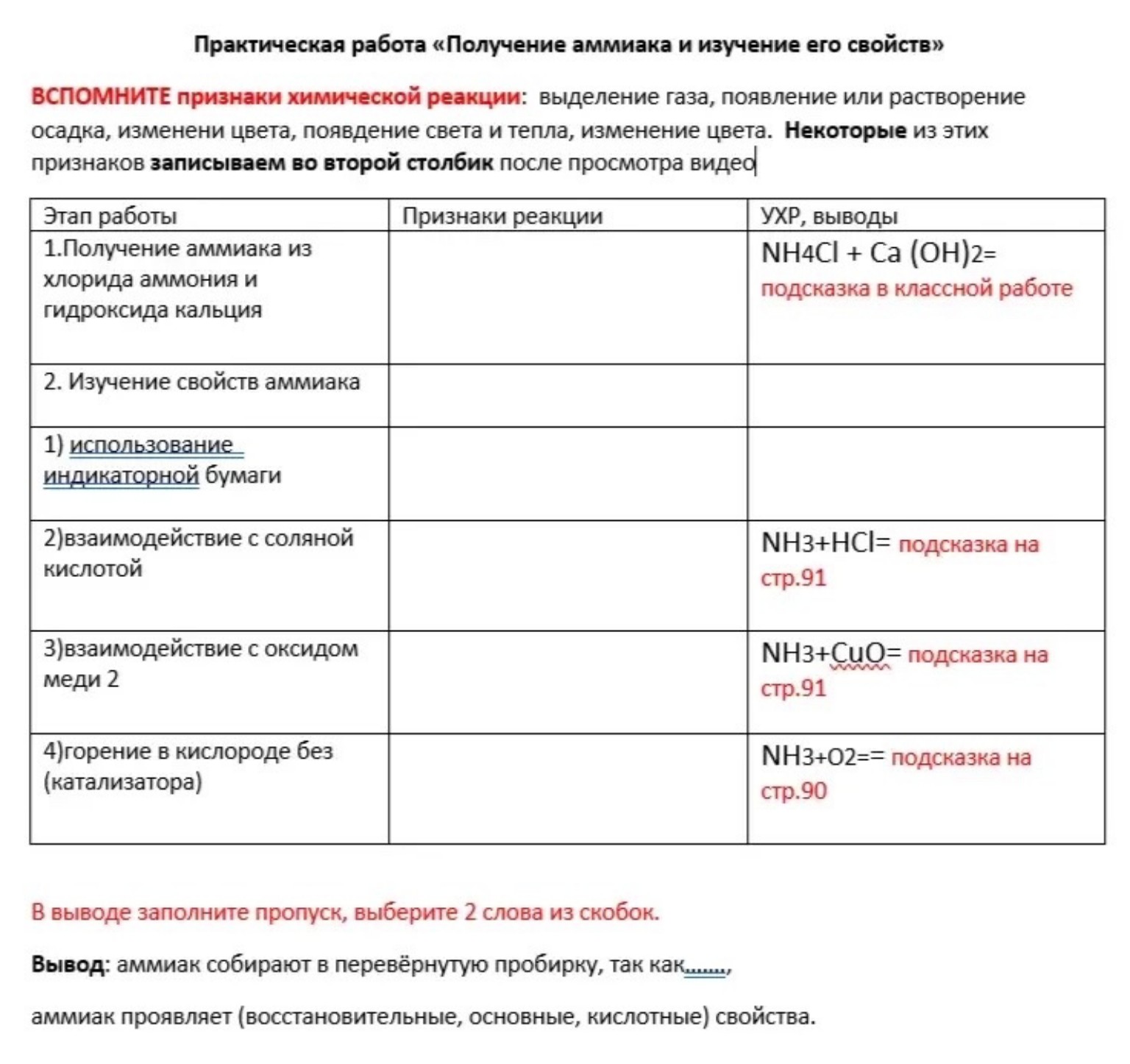
Практическая работа «Получение аммиака и изучение его свойств»
ВСПОМНИТЕ признаки химической реакции: выделение газа, появление или растворение осадка, изменении цвета, появление света и тепла, изменение цвета. Некоторые из этих признаков записываем во второй столбик после просмотра видео
| Этап работы | Признаки реакции | УХР, выводы |
| 1. Получение аммиака из хлорида аммония и гидроксида кальция | Выделение газа с характерным резким запахом | \(2\text{NH}_4\text{Cl} + \text{Ca}(\text{OH})_2 = \text{CaCl}_2 + 2\text{NH}_3\uparrow + 2\text{H}_2\text{O}\) |
| 2. Изучение свойств аммиака | ||
| 1) использование индикаторной бумаги | Изменение цвета влажной красной лакмусовой бумаги на синий (или универсального индикатора на синий/зеленый) | Аммиак растворяется в воде, образуя гидроксид аммония, который является слабым основанием: \(\text{NH}_3 + \text{H}_2\text{O} \rightleftharpoons \text{NH}_4\text{OH}\) |
| 2) взаимодействие с соляной кислотой | Образование белого дыма (белых кристаллов) | \(\text{NH}_3 + \text{HCl} = \text{NH}_4\text{Cl}\) |
| 3) взаимодействие с оксидом меди 2 | Изменение цвета черного оксида меди на красный (образование меди), выделение газа (азота), образование паров воды | \(2\text{NH}_3 + 3\text{CuO} = 3\text{Cu} + \text{N}_2\uparrow + 3\text{H}_2\text{O}\) |
| 4) горение в кислороде без (катализатора) | Горение с образованием желтовато-зеленого пламени, образование газа (азота) и паров воды | \(4\text{NH}_3 + 3\text{O}_2 = 2\text{N}_2\uparrow + 6\text{H}_2\text{O}\) |
В выводе заполните пропуск, выберите 2 слова из скобок.
Вывод: аммиак собирают в перевёрнутую пробирку, так как он легче воздуха, аммиак проявляет (восстановительные, основные, кислотные) свойства.
Исправленный вывод: аммиак собирают в перевёрнутую пробирку, так как он легче воздуха, аммиак проявляет (восстановительные, основные, кислотные) свойства.