Задача: Получение водорода в лаборатории
Вопрос:
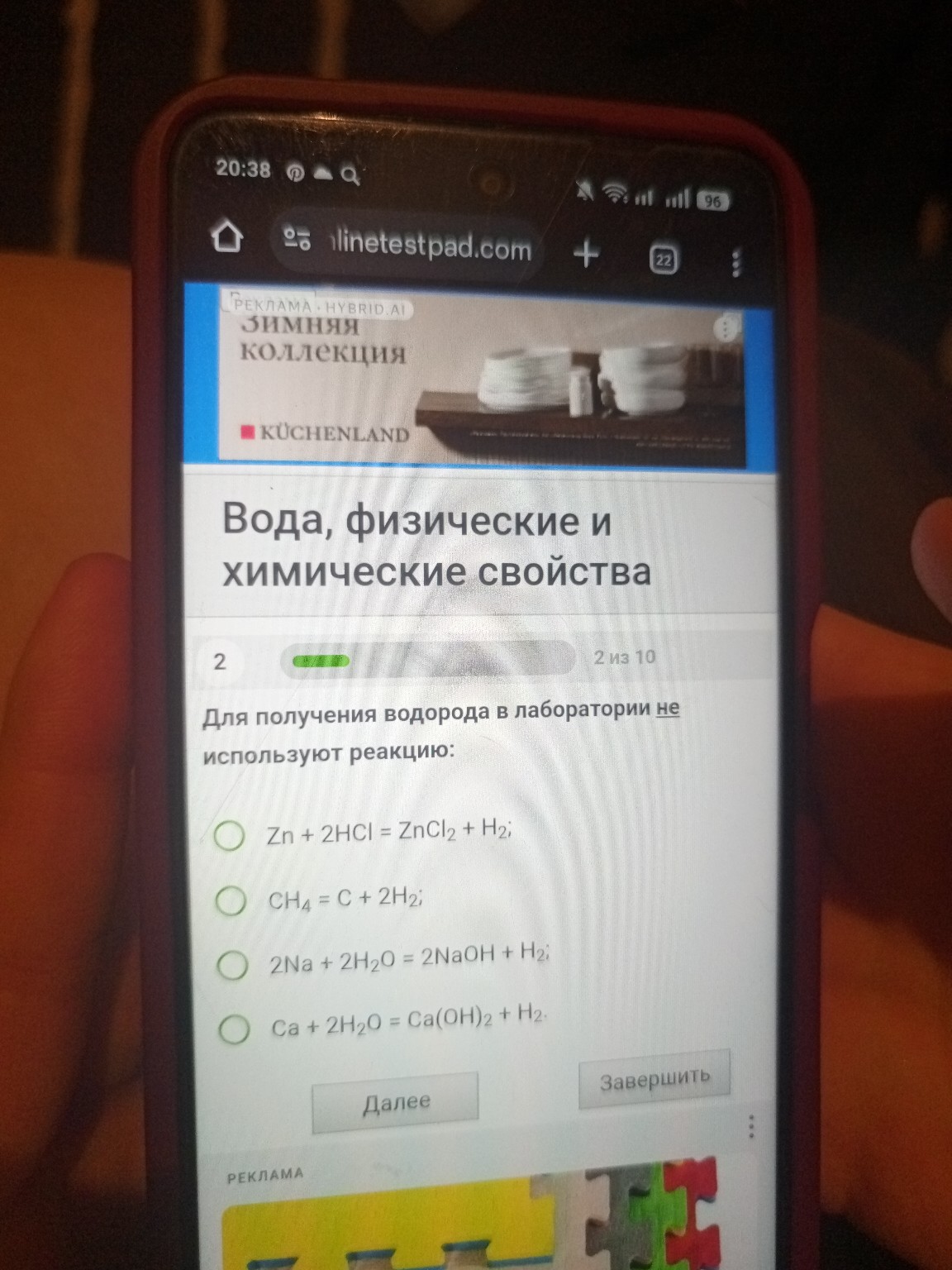
Для получения водорода в лаборатории не используют реакцию:- \( Zn + 2HCl = ZnCl_2 + H_2 \)
- \( CH_4 = C + 2H_2 \)
- \( 2Na + 2H_2O = 2NaOH + H_2 \)
- \( Ca + 2H_2O = Ca(OH)_2 + H_2 \)
Решение:
Для получения водорода в лаборатории обычно используют реакции, которые легко контролировать и которые не представляют большой опасности. Рассмотрим каждую из предложенных реакций:- \( Zn + 2HCl = ZnCl_2 + H_2 \) Эта реакция представляет собой взаимодействие активного металла (цинка) с кислотой (соляной кислотой). В результате реакции выделяется газообразный водород. Эта реакция широко используется в лабораториях для получения водорода, так как она протекает достаточно активно, но при этом легко контролируется.
- \( CH_4 = C + 2H_2 \) Эта реакция представляет собой термическое разложение метана (пиролиз метана) на углерод и водород. Для протекания этой реакции требуются очень высокие температуры (более 1000°C). Такие условия сложно создать и поддерживать в обычной школьной или университетской лаборатории, а также это не является безопасным методом для получения водорода в небольших количествах. Поэтому эта реакция не используется для лабораторного получения водорода.
- \( 2Na + 2H_2O = 2NaOH + H_2 \) Эта реакция представляет собой взаимодействие щелочного металла (натрия) с водой. Натрий очень активно реагирует с водой, выделяя водород и образуя гидроксид натрия. Реакция протекает очень бурно, с выделением большого количества тепла, что может привести к воспламенению водорода. Из-за высокой активности и опасности эта реакция не используется для получения водорода в лаборатории.
- \( Ca + 2H_2O = Ca(OH)_2 + H_2 \) Эта реакция представляет собой взаимодействие щелочноземельного металла (кальция) с водой. Кальций также реагирует с водой с выделением водорода, но менее бурно, чем натрий. Тем не менее, реакция достаточно активна и может быть опасной, особенно при использовании больших количеств кальция. Хотя теоретически водород выделяется, на практике для лабораторного получения водорода предпочитают более безопасные и контролируемые методы, такие как реакция цинка с кислотой.
Исходя из анализа, реакции с натрием и кальцием с водой, а также термическое разложение метана, не являются подходящими для безопасного и контролируемого получения водорода в лаборатории. Однако, вопрос сформулирован как "не используют реакцию", подразумевая одну из них. Реакция термического разложения метана требует экстремальных условий, которые не характерны для лабораторных условий. Реакции щелочных и щелочноземельных металлов с водой слишком бурные и опасные.
В контексте школьной химии, наиболее часто упоминаемой и используемой реакцией для получения водорода является взаимодействие металлов (например, цинка, железа) с кислотами. Реакции щелочных металлов с водой категорически не используются из-за их взрывоопасности. Термическое разложение метана – это промышленный метод, а не лабораторный.
Если выбирать один ответ, который *не* используется в лаборатории, то реакция термического разложения метана (2) является наименее применимой в лабораторных условиях из-за высоких температур. Реакции с натрием и кальцием с водой также не используются из-за опасности, но они все же являются химическими реакциями, которые можно провести, хотя и с большой осторожностью. Однако, термическое разложение метана требует оборудования, которое обычно отсутствует в стандартной лаборатории.
Давайте пересмотрим. В лабораторной практике для получения водорода *не* используют реакции, которые слишком опасны или требуют слишком сложных условий. Реакция \( Zn + 2HCl = ZnCl_2 + H_2 \) – это классический лабораторный метод. Реакция \( 2Na + 2H_2O = 2NaOH + H_2 \) – очень опасна, не используется. Реакция \( Ca + 2H_2O = Ca(OH)_2 + H_2 \) – также опасна, хотя и менее, чем с натрием, но тоже не является предпочтительным лабораторным методом. Реакция \( CH_4 = C + 2H_2 \) – это промышленный метод, требующий высоких температур, не лабораторный.
Вопрос "не используют реакцию" может иметь несколько правильных ответов, если рассматривать их строго. Однако, обычно в таких тестах подразумевается наиболее очевидный или категорически неприменимый метод.
Реакции с натрием и кальцием с водой, хотя и выделяют водород, являются слишком бурными и опасными для контролируемого лабораторного получения водорода. Реакция термического разложения метана требует очень высоких температур, что делает ее непригодной для обычной лаборатории.
Если нужно выбрать *одну* реакцию, которая *не* используется, то все реакции, кроме первой, подходят под это описание. Однако, реакция с натрием (3) является наиболее опасной и категорически запрещенной для получения водорода в лаборатории из-за риска взрыва и пожара. Реакция с кальцием (4) также опасна, но менее. Реакция разложения метана (2) не используется из-за высоких температур.
В школьной программе часто подчеркивается опасность взаимодействия щелочных металлов с водой. Поэтому реакция с натрием (3) является очень сильным кандидатом на ответ.
Давайте еще раз подумаем о формулировке "не используют". 1. \( Zn + 2HCl = ZnCl_2 + H_2 \) - Используют. 2. \( CH_4 = C + 2H_2 \) - Не используют (промышленный метод, высокие температуры). 3. \( 2Na + 2H_2O = 2NaOH + H_2 \) - Не используют (очень опасно). 4. \( Ca + 2H_2O = Ca(OH)_2 + H_2 \) - Не используют (опасно, хотя и менее, чем с Na).
Если вопрос подразумевает *наиболее* неприменимую или категорически неиспользуемую реакцию, то это может быть как реакция с натрием (из-за опасности), так и реакция разложения метана (из-за условий). В школьной химии, когда говорят о лабораторном получении водорода, обычно имеют в виду реакции металлов с кислотами. Реакции щелочных металлов с водой всегда приводятся как примеры очень бурных и опасных реакций, которые не используются для получения водорода.
Выберем наиболее однозначный ответ. Реакция \( CH_4 = C + 2H_2 \) является промышленным методом получения водорода, а не лабораторным. Для ее проведения требуются специальные установки и очень высокие температуры, что делает ее непригодной для обычной лаборатории. Реакции с натрием и кальцием с водой, хотя и опасны, все же могут быть проведены в лаборатории (с большой осторожностью и в очень малых количествах для демонстрации свойств, но не для получения водорода).
Таким образом, реакция термического разложения метана (2) является наиболее подходящим ответом, так как она не является лабораторным методом получения водорода по своей сути.