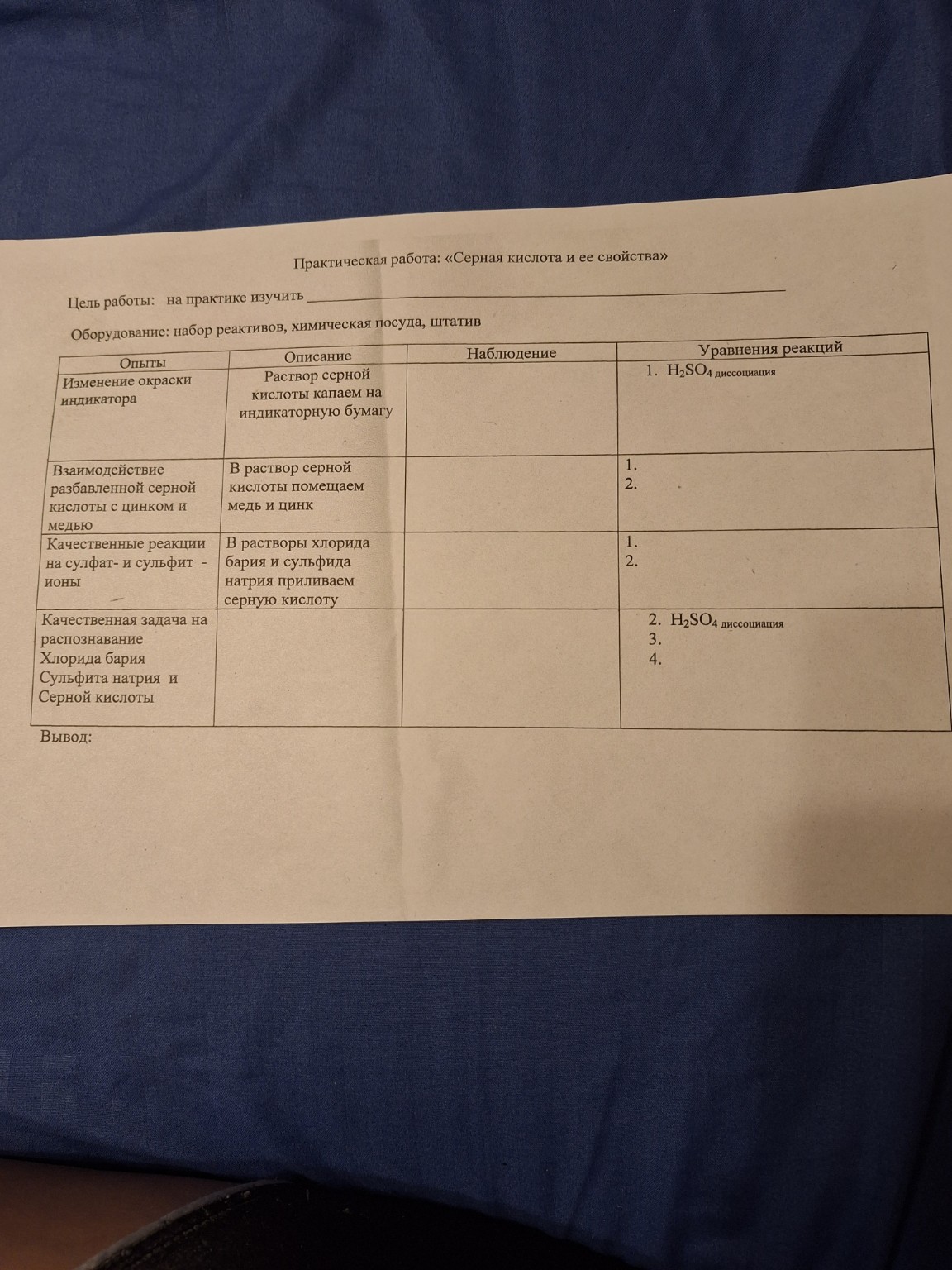
| Опыты | Описание | Наблюдение | Уравнения реакций |
| Изменение окраски индикатора | Раствор серной кислоты капаем на индикаторную бумагу | Индикаторная бумага краснеет (или изменяет цвет на красный/розовый, в зависимости от типа индикатора, например, лакмус) | 1. \( \text{H}_2\text{SO}_4 \) диссоциация \( \text{H}_2\text{SO}_4 \rightleftharpoons \text{H}^+ + \text{HSO}_4^- \) \( \text{HSO}_4^- \rightleftharpoons \text{H}^+ + \text{SO}_4^{2-} \) (или суммарно: \( \text{H}_2\text{SO}_4 \rightleftharpoons 2\text{H}^+ + \text{SO}_4^{2-} \)) |
| Взаимодействие разбавленной серной кислоты с цинком и медью | В раствор серной кислоты помещаем медь и цинк | 1. С цинком: наблюдается выделение пузырьков газа. 2. С медью: видимых изменений не происходит. |
1. \( \text{Zn} + \text{H}_2\text{SO}_4 \text{ (разб.)} \rightarrow \text{ZnSO}_4 + \text{H}_2 \uparrow \) 2. \( \text{Cu} + \text{H}_2\text{SO}_4 \text{ (разб.)} \rightarrow \text{реакция не идет} \) |
| Качественные реакции на сульфат- и сульфит-ионы | В растворы хлорида бария и сульфида натрия приливаем серную кислоту | 1. С хлоридом бария: образуется белый осадок. 2. С сульфидом натрия: выделяется газ с резким запахом (запах тухлых яиц). |
1. \( \text{BaCl}_2 + \text{H}_2\text{SO}_4 \rightarrow \text{BaSO}_4 \downarrow + 2\text{HCl} \) 2. \( \text{Na}_2\text{S} + \text{H}_2\text{SO}_4 \rightarrow \text{Na}_2\text{SO}_4 + \text{H}_2\text{S} \uparrow \) |
| Качественная задача на распознавание Хлорида бария, Сульфита натрия и Серной кислоты | 2. \( \text{H}_2\text{SO}_4 \) диссоциация (уже указана выше, здесь можно повторить или указать, что это свойство кислоты) 3. \( \text{BaCl}_2 + \text{H}_2\text{SO}_4 \rightarrow \text{BaSO}_4 \downarrow + 2\text{HCl} \) 4. \( \text{Na}_2\text{SO}_3 + \text{H}_2\text{SO}_4 \rightarrow \text{Na}_2\text{SO}_4 + \text{H}_2\text{O} + \text{SO}_2 \uparrow \) |
schoolХимия
verifiedРешено AI
Практическая работа: Серная кислота и ее свойства (решение)
help_outlineУсловие задачи
lightbulbКраткий ответ
Представлено готовое решение практической работы по химии, демонстрирующее свойства серной кислоты. Включает описание опытов, наблюдения и уравнения химических реакций.
Подробное решение
Вот заполненная практическая работа по теме "Серная кислота и ее свойства", оформленная так, чтобы было удобно переписать в тетрадь.
Практическая работа: «Серная кислота и ее свойства»
Цель работы: на практике изучить свойства серной кислоты.
Оборудование: набор реактивов, химическая посуда, штатив.
Вывод:
В ходе практической работы были изучены основные свойства серной кислоты.
1. Серная кислота является сильной кислотой, что подтверждается изменением цвета индикатора на красный.
2. Разбавленная серная кислота реагирует с металлами, стоящими в ряду активности до водорода (например, с цинком), с выделением водорода. С металлами, стоящими после водорода (например, с медью), разбавленная серная кислота не реагирует.
3. Качественной реакцией на сульфат-ион \( \text{SO}_4^{2-} \) является образование белого осадка сульфата бария \( \text{BaSO}_4 \) при взаимодействии с солями бария.
4. Качественной реакцией на сульфид-ион \( \text{S}^{2-} \) является выделение сероводорода \( \text{H}_2\text{S} \) с характерным запахом при взаимодействии с кислотами.
5. Качественной реакцией на сульфит-ион \( \text{SO}_3^{2-} \) является выделение сернистого газа \( \text{SO}_2 \) при взаимодействии с кислотами.