schoolФизика
verifiedРешено AI
Решение задачи C7H9N2Cl2. Контрольная работа №3, Вариант 13
help_outlineУсловие задачи
lightbulbКраткий ответ
Задача решена с определением нечетноэлектронности молекулярного иона и расчетом фактора ненасыщенности. Подробное решение для контрольной работы по химии.
Подробное решение
Вот решение задач, оформленное так, чтобы было удобно переписать в тетрадь школьнику.
Контрольная работа № 3
Вариант 13
1. Исходя из брутто-формулы молекулярного иона сделайте вывод о его нечетноэлектронности. Фактор ненасыщенности определите двумя способами.
C\(_{7}\)H\(_{9}\)N\(_{2}\)Cl\(_{2}\)
Решение:
1. Определение нечетноэлектронности:
Для определения нечетноэлектронности молекулярного иона необходимо подсчитать сумму валентностей всех атомов. Если сумма нечетная, то ион нечетноэлектронный.
Валентности:
C (углерод) - 4
H (водород) - 1
N (азот) - 3
Cl (хлор) - 1
Подсчет суммы валентностей:
C: \(7 \times 4 = 28\)
H: \(9 \times 1 = 9\)
N: \(2 \times 3 = 6\)
Cl: \(2 \times 1 = 2\)
Общая сумма валентностей: \(28 + 9 + 6 + 2 = 45\)
Так как сумма валентностей (45) является нечетным числом, молекулярный ион C\(_{7}\)H\(_{9}\)N\(_{2}\)Cl\(_{2}\) является нечетноэлектронным.
2. Определение фактора ненасыщенности (ФН) двумя способами:
Способ 1: По формуле для органических соединений, содержащих C, H, N, O, галогены (X).
Формула:
\[\text{ФН} = \frac{2C + 2 + N - H - X}{2}\]
Где:
C = количество атомов углерода = 7
H = количество атомов водорода = 9
N = количество атомов азота = 2
X = количество атомов галогенов (Cl) = 2
Подставляем значения в формулу:
\[\text{ФН} = \frac{2 \times 7 + 2 + 2 - 9 - 2}{2}\]
\[\text{ФН} = \frac{14 + 2 + 2 - 9 - 2}{2}\]
\[\text{ФН} = \frac{18 - 11}{2}\]
\[\text{ФН} = \frac{7}{2}\]
\[\text{ФН} = 3,5\]
Способ 2: По формуле для определения числа двойных связей и циклов.
Для этого сначала определим максимально возможное количество атомов водорода для насыщенного соединения с данным числом атомов углерода и азота.
Формула для насыщенного соединения с C, H, N, X: C\(_{n}\)H\(_{2n+2+N-X}\)
В нашем случае: C\(_{7}\)H\(_{2 \times 7 + 2 + 2 - 2}\) = C\(_{7}\)H\(_{14 + 2 + 2 - 2}\) = C\(_{7}\)H\(_{16}\)
Максимальное количество водорода для насыщенного соединения = 16.
Фактор ненасыщенности (ФН) = \(\frac{\text{H}_{\text{насыщенное}} - \text{H}_{\text{данное}}}{2}\)
Где:
H\(_{\text{насыщенное}}\) = 16
H\(_{\text{данное}}\) = 9
Подставляем значения:
\[\text{ФН} = \frac{16 - 9}{2}\]
\[\text{ФН} = \frac{7}{2}\]
\[\text{ФН} = 3,5\]
Вывод: Молекулярный ион C\(_{7}\)H\(_{9}\)N\(_{2}\)Cl\(_{2}\) является нечетноэлектронным. Фактор ненасыщенности равен 3,5.
2. Определите брутто-формулу соединения по интенсивности изотопных пиков.
59 (100), 60 (3,8), 61 (0,05)
Решение:
Для определения брутто-формулы по изотопным пикам используются соотношения интенсивностей пиков M+1 и M+2 к пику M (молекулярный ион).
Пик M = 59 (интенсивность 100%)
Пик M+1 = 60 (интенсивность 3,8%)
Пик M+2 = 61 (интенсивность 0,05%)
1. Определение количества атомов углерода (C):
Интенсивность пика M+1 в основном обусловлена наличием изотопа \(^{13}\)C. Природное содержание \(^{13}\)C составляет примерно 1,1% от \(^{12}\)C.
Формула для определения числа атомов углерода (n\(_{C}\)):
\[n_C = \frac{I_{M+1}}{I_M} \times \frac{100}{1,1}\]
Где:
I\(_{M+1}\) = интенсивность пика M+1 = 3,8%
I\(_{M}\) = интенсивность пика M = 100%
Подставляем значения:
\[n_C = \frac{3,8}{100} \times \frac{100}{1,1}\]
\[n_C = \frac{3,8}{1,1}\]
\[n_C \approx 3,45\]
Округляем до ближайшего целого числа: \(n_C = 3\).
2. Определение наличия других элементов:
Пик M+2 (интенсивность 0,05%) очень мал. Это указывает на отсутствие или очень малое количество атомов, имеющих значительные изотопы M+2, таких как Cl, Br, S.
Если бы присутствовал Cl, пик M+2 был бы около 33% от M.
Если бы присутствовал Br, пик M+2 был бы около 98% от M.
Если бы присутствовал S, пик M+2 был бы около 4,4% от M.
Поскольку интенсивность M+2 очень низкая (0,05%), можно предположить, что в соединении нет атомов Cl, Br, S.
3. Предполагаемая брутто-формула:
Молекулярная масса (M) = 59.
Если \(n_C = 3\), то масса углерода = \(3 \times 12 = 36\).
Остаток массы = \(59 - 36 = 23\).
Эта масса может соответствовать атомам водорода и/или азота.
Если это только водород, то \(n_H = 23\). Формула C\(_{3}\)H\(_{23}\) невозможна, так как максимальное количество водорода для 3 атомов углерода (насыщенный алкан) = \(2 \times 3 + 2 = 8\).
Рассмотрим наличие азота (N). Азот имеет атомную массу 14.
Если есть 1 атом N: \(36 + 14 = 50\). Остаток массы = \(59 - 50 = 9\). Это 9 атомов водорода.
Брутто-формула: C\(_{3}\)H\(_{9}\)N.
Проверим массу: \(3 \times 12 + 9 \times 1 + 1 \times 14 = 36 + 9 + 14 = 59\). Совпадает.
Проверим нечетноэлектронность: \(3 \times 4 + 9 \times 1 + 1 \times 3 = 12 + 9 + 3 = 24\) (четное). Молекулярный ион с нечетным числом азотов должен быть нечетноэлектронным. Здесь 1 атом N, значит, ион должен быть нечетноэлектронным.
Однако, если это молекулярный ион, то он должен быть нечетноэлектронным, если содержит нечетное число атомов азота.
Если это ион, то он может быть \(M^{+}\) или \(M^{+\cdot}\).
Если это молекулярный ион, то его масса 59.
C\(_{3}\)H\(_{9}\)N: \(3 \times 12 + 9 \times 1 + 1 \times 14 = 36 + 9 + 14 = 59\).
Проверим правило азота: если молекулярная масса нечетная, то соединение содержит нечетное число атомов азота. Масса 59 нечетная, и мы имеем 1 атом азота (нечетное число). Это согласуется.
Рассмотрим другие варианты:
Если есть 2 атома N: \(36 + 2 \times 14 = 36 + 28 = 64\). Это больше 59, поэтому 2 атома N не подходят.
Вывод: Наиболее вероятная брутто-формула соединения C\(_{3}\)H\(_{9}\)N.
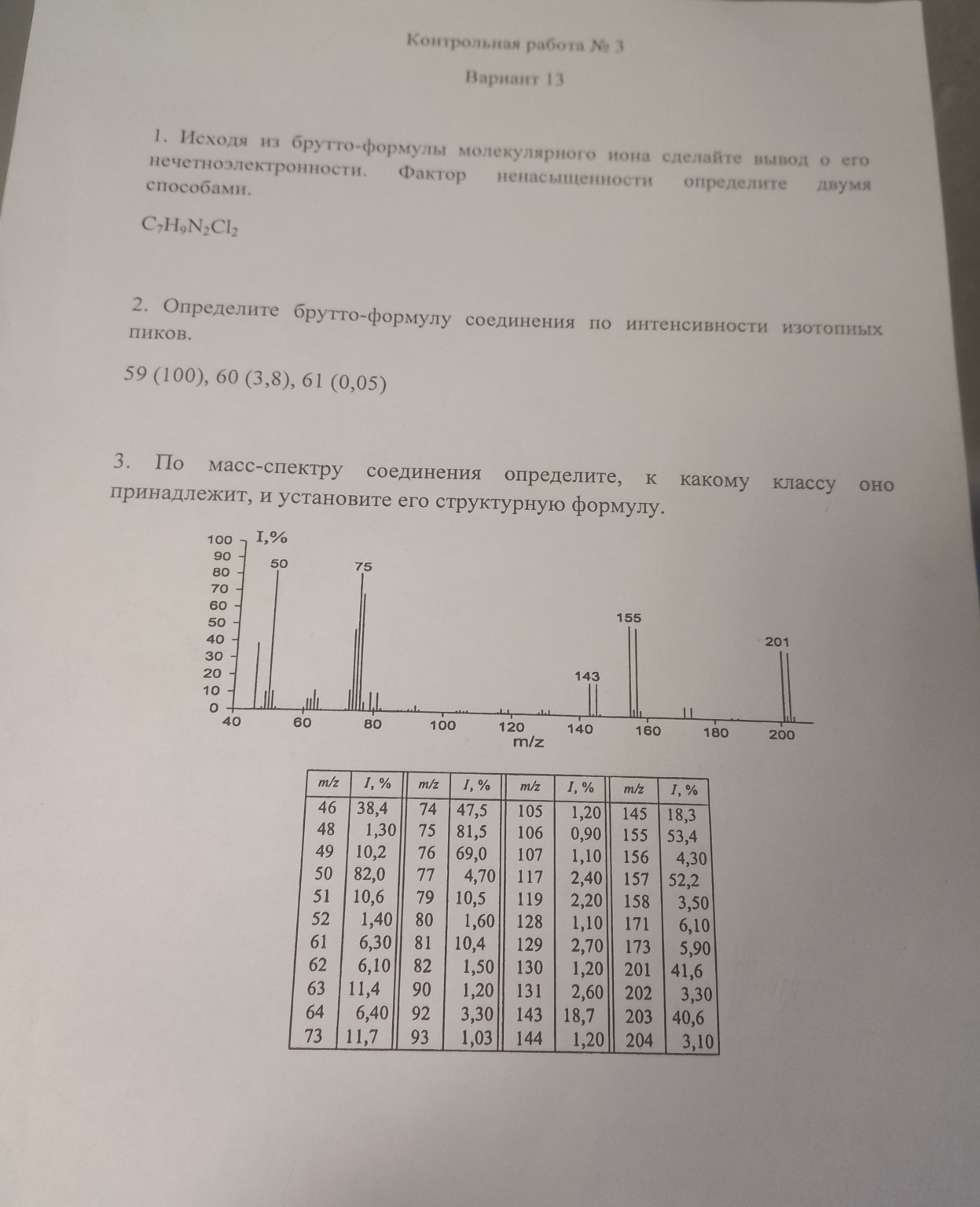
3. По масс-спектру соединения определите, к какому классу оно принадлежит, и установите его структурную формулу.
(Приведен масс-спектр и таблица с m/z и I, %)
Решение:
1. Определение молекулярной массы (M) и молекулярного иона:
Молекулярный ион (M\(^{+\cdot}\)) обычно является пиком с наибольшим значением m/z, если он достаточно стабилен.
Из масс-спектра и таблицы видно, что самый тяжелый пик с заметной интенсивностью - это пик с m/z = 201 (интенсивность 41,6%).
Пик с m/z = 202 имеет интенсивность 3,30%.
Пик с m/z = 203 имеет интенсивность 40,6%.
Пик с m/z = 204 имеет интенсивность 3,10%.
Наличие пиков M и M+2 примерно одинаковой интенсивности (201 и 203) с соотношением примерно 1:1, а также пиков M+1 и M+3 с меньшей интенсивностью (202 и 204) указывает на присутствие атомов брома (Br) или хлора (Cl).
Для брома (Br): \(^{79}\)Br и \(^{81}\)Br имеют почти одинаковую природную распространенность (примерно 50,5% и 49,5% соответственно). Это приводит к пикам M и M+2 с соотношением 1:1.
Для хлора (Cl): \(^{35}\)Cl и \(^{37}\)Cl имеют соотношение примерно 3:1 (75,8% и 24,2% соответственно). Это приводит к пикам M и M+2 с соотношением 3:1.
В нашем случае, пики 201 (41,6%) и 203 (40,6%) имеют соотношение примерно 1:1. Это очень сильное указание на наличие одного атома брома в молекуле.
Таким образом, молекулярный ион M\(^{+\cdot}\) соответствует m/z = 201 (для \(^{79}\)Br) и m/z = 203 (для \(^{81}\)Br).
Молекулярная масса (M) = 201 (для изотопа \(^{79}\)Br).
2. Определение брутто-формулы:
Предположим, что в молекуле есть один атом брома (Br). Атомная масса Br \(\approx\) 79.
Остаток массы = \(201 - 79 = 122\).
Теперь нужно найти комбинацию атомов C, H, O, N, которая дает массу 122.
Используем правило азота: молекулярная масса 201 является нечетной, что указывает на нечетное число атомов азота в молекуле.
Попробуем подобрать количество атомов углерода (C).
Если \(n_C = 10\), масса C = \(10 \times 12 = 120\). Остаток массы = \(122 - 120 = 2\).
Если это 2 атома водорода (H), то формула C\(_{10}\)H\(_{2}\)Br.
Проверим фактор ненасыщенности для C\(_{10}\)H\(_{2}\)Br:
\[\text{ФН} = \frac{2 \times 10 + 2 - 2 - 1}{2} = \frac{20 + 2 - 2 - 1}{2} = \frac{19}{2} = 9,5\]
Такой высокий ФН и малое количество водорода для 10 атомов углерода (C\(_{10}\)H\(_{2}\)) маловероятны для стабильного соединения.
Попробуем \(n_C = 9\), масса C = \(9 \times 12 = 108\). Остаток массы = \(122 - 108 = 14\).
Масса 14 может быть:
а) 14 атомов водорода (H): C\(_{9}\)H\(_{14}\)Br.
Проверим ФН: \[\text{ФН} = \frac{2 \times 9 + 2 - 14 - 1}{2} = \frac{18 + 2 - 14 - 1}{2} = \frac{5}{2} = 2,5\]
Это возможно.
б) 1 атом азота (N): C\(_{9}\)H\(_{0}\)NBr. Невозможно, так как нет водорода.
в) 1 атом кислорода (O) и 2 атома водорода (H): C\(_{9}\)H\(_{2}\)OBr.
Проверим ФН: \[\text{ФН} = \frac{2 \times 9 + 2 - 2 - 1}{2} = \frac{18 + 2 - 2 - 1}{2} = \frac{17}{2} = 8,5\]
Маловероятно.
Попробуем \(n_C = 8\), масса C = \(8 \times 12 = 96\). Остаток массы = \(122 - 96 = 26\).
Масса 26 может быть:
а) 26 атомов водорода (H): C\(_{8}\)H\(_{26}\)Br. Невозможно, так как максимальное количество водорода для 8 атомов углерода = \(2 \times 8 + 2 = 18\).
б) 1 атом азота (N) и 12 атомов водорода (H): \(14 + 12 = 26\). Формула C\(_{8}\)H\(_{12}\)NBr.
Проверим массу: \(8 \times 12 + 12 \times 1 + 1 \times 14 + 1 \times 79 = 96 + 12 + 14 + 79 = 201\). Совпадает.
Проверим правило азота: 1 атом азота (нечетное число), молекулярная масса 201 (нечетная). Совпадает.
Проверим ФН:
\[\text{ФН} = \frac{2 \times 8 + 2 + 1 - 12 - 1}{2} = \frac{16 + 2 + 1 - 12 - 1}{2} = \frac{19 - 13}{2} = \frac{6}{2} = 3\]
ФН = 3 является разумным значением для органического соединения.
Таким образом, наиболее вероятная брутто-формула: C\(_{8}\)H\(_{12}\)NBr.
3. Анализ фрагментации (основные пики):
M\(^{+\cdot}\) = 201/203 (C\(_{8}\)H\(_{12}\)NBr)
Пик m/z = 155 (интенсивность 53,4%):
\(201 - 155 = 46\).
Масса 46 может соответствовать:
- CH\(_{2}\)Br (12+2+79 = 93) - нет
- C\(_{2}\)H\(_{2}\)N (24+2+14 = 40) - нет
- C\(_{3}\)H\(_{10}\) (36+10 = 46) - возможно
- C\(_{2}\)H\(_{4}\)N (24+4+14 = 42) - нет
- C\(_{3}\)H\(_{8}\)N (36+8+14 = 58) - нет
- C\(_{2}\)H\(_{6}\)N (24+6+14 = 44) - нет
- C\(_{3}\)H\(_{10}\) (46) - это потеря фрагмента C\(_{3}\)H\(_{10}\) из молекулы.
- Потеря Br (79) привела бы к пику \(201 - 79 = 122\). Пик 122 имеет интенсивность 1,50%.
- Потеря HBr (80) привела бы к пику \(201 - 80 = 121\). Пик 121 имеет интенсивность 2,60%.
- Потеря CH\(_{3}\) (15) привела бы к пику \(201 - 15 = 186\). Нет значимого пика.
- Потеря C\(_{2}\)H\(_{5}\) (29) привела бы к пику \(201 - 29 = 172\). Нет значимого пика.
- Потеря C\(_{3}\)H\(_{7}\) (43) привела бы к пику \(201 - 43 = 158\). Пик 158 имеет интенсивность 3,50%. Это может быть потеря пропильной группы.
- Потеря C\(_{4}\)H\(_{9}\) (57) привела бы к пику \(201 - 57 = 144\). Пик 144 имеет интенсивность 1,20%.
- Потеря C\(_{5}\)H\(_{11}\) (71) привела бы к пику \(201 - 71 = 130\). Пик 130 имеет интенсивность 1,50%.
Пик m/z = 143 (интенсивность 18,7%):
\(201 - 143 = 58\).
Масса 58 может соответствовать:
- C\(_{4}\)H\(_{10}\) (48+10 = 58) - бутан
- C\(_{3}\)H\(_{8}\)N (36+8+14 = 58) - пропиламин
- C\(_{2}\)H\(_{4}\)O\(_{2}\) (24+4+32 = 60) - нет
- C\(_{3}\)H\(_{6}\)O (36+6+16 = 58) - ацетон
- C\(_{2}\)H\(_{4}\)S (24+4+32 = 60) - нет
Пик m/z = 75 (интенсивность 81,5%):
Это очень интенсивный пик, часто называемый базовым пиком. Он указывает на очень стабильный фрагмент.
Масса 75.
Если это фрагмент, содержащий азот:
- C\(_{4}\)H\(_{9}\)N (48+9+14 = 71) - нет
- C\(_{3}\)H\(_{9}\)N (36+9+14 = 59) - нет
- C\(_{4}\)H\(_{13}\)N (48+13+14 = 75) - возможно, если это ион.
- C\(_{5}\)H\(_{15}\)N (60+15+14 = 89) - нет
- C\(_{3}\)H\(_{5}\)O\(_{2}\) (36+5+32 = 73) - нет
- C\(_{2}\)H\(_{5}\)O\(_{2}\) (24+5+32 = 61) - нет
- C\(_{4}\)H\(_{9}\)O (48+9+16 = 73) - нет
- C\(_{5}\)H\(_{15}\)N (75) - это может быть ион C\(_{5}\)H\(_{15}\)N\(^{+}\).
- C\(_{4}\)H\(_{13}\)N (75) - это может быть ион C\(_{4}\)H\(_{13}\)N\(^{+}\).
- C\(_{3}\)H\(_{9}\)N (59) - нет
- C\(_{5}\)H\(_{15}\)N (75) - это может быть ион C\(_{5}\)H\(_{15}\)N\(^{+}\).
- C\(_{4}\)H\(_{13}\)N (75) - это может быть ион C\(_{4}\)H\(_{13}\)N\(^{+}\).
Если молекула C\(_{8}\)H\(_{12}\)NBr, то потеря Br (79) дает фрагмент C\(_{8}\)H\(_{12}\)N с массой 122.
Пик 122 имеет интенсивность 1,50%. Это не базовый пик.
Рассмотрим фрагментацию аминов. Амины часто дают интенсивные пики за счет \(\alpha\)-расщепления.
Если это амин, то фрагмент с m/z = 75 может быть:
- [CH\(_{2}\)NH\(_{2}\)]\(^{+}\) = 30
- [CH\(_{2}\)CH\(_{2}\)NH\(_{2}\)]\(^{+}\) = 44
- [CH\(_{2}\)CH\(_{2}\)CH\(_{2}\)NH\(_{2}\)]\(^{+}\) = 58
- [CH\(_{2}\)CH\(_{2}\)CH\(_{2}\)CH\(_{2}\)NH\(_{2}\)]\(^{+}\) = 72
- [CH\(_{2}\)CH\(_{2}\)CH\(_{2}\)CH\(_{2}\)CH\(_{2}\)NH\(_{2}\)]\(^{+}\) = 86
Это не соответствует 75.
Однако, если это замещенный амин, например, с алкильными группами.
Например, если это третичный амин.
Рассмотрим фрагмент 75.
Если это C\(_{4}\)H\(_{13}\)N, то это может быть ион, образованный из амина.
Например, если это N,N-диэтилпропиламин.
Молекулярная масса N,N-диэтилпропиламина:
C\(_{7}\)H\(_{17}\)N: \(7 \times 12 + 17 \times 1 + 1 \times 14 = 84 + 17 + 14 = 115\). Это не 201.
Вернемся к брутто-формуле C\(_{8}\)H\(_{12}\)NBr.
ФН = 3. Это может быть ароматическое кольцо (ФН=4) с одним заместителем, или два цикла и одна двойная связь, или три двойные связи.
Наличие брома и азота.
Пик m/z = 75 (базовый пик)
Пик m/z = 74 (47,5%)
Пик m/z = 76 (69,0%)
Пик m/z = 77 (4,70%)
Пик m/z = 78 (10,5%)
Пик m/z = 79 (10,5%)
Пик m/z = 80 (1,60%)
Пик m/z = 81 (10,4%)
Пики 74, 75, 76, 77, 78, 79, 80, 81.
Пик 79 (10,5%) и 81 (10,4%) с соотношением 1:1 указывает на наличие брома в этом фрагменте.
Если фрагмент содержит Br, то его масса должна быть больше 79.
Например, [C\(_{6}\)H\(_{4}\)Br]\(^{+}\) = \(6 \times 12 + 4 \times 1 + 79 = 72 + 4 + 79 = 155\). Это пик 155.
Пик 155 (53,4%) и 157 (52,2%) с соотношением 1:1. Это подтверждает наличие Br в фрагменте 155.
Значит, фрагмент 155 - это [C\(_{6}\)H\(_{4}\)Br]\(^{+}\) или [C\(_{6}\)H\(_{5}\)Br]\(^{+}\) (масса 156).
Если это [C\(_{6}\)H\(_{4}\)Br]\(^{+}\), то это бромофенильный ион.
Если это [C\(_{6}\)H\(_{5}\)Br]\(^{+}\), то это бромобензол.
Если молекула содержит бромофенильный фрагмент, то это ароматическое соединение.
Брутто-формула C\(_{8}\)H\(_{12}\)NBr.
Если есть C\(_{6}\)H\(_{4}\)Br, то остается C\(_{2}\)H\(_{8}\)N.
Масса C\(_{2}\)H\(_{8}\)N = \(2 \times 12 + 8 \times 1 + 1 \times 14 = 24 + 8 + 14 = 46\).
Потеря фрагмента 46 из молекулы 201 дает 155.
Это очень правдоподобно. Фрагмент 46 может быть C\(_{2}\)H\(_{8}\)N.
Это может быть этиламин (C\(_{2}\)H\(_{7}\)N, масса 45) или диметиламин (C\(_{2}\)H\(_{7}\)N, масса 45).
Но у нас C\(_{2}\)H\(_{8}\)N. Это может быть ион.
Рассмотрим пик m/z = 75 (базовый пик).
Если это фрагмент, содержащий азот, но не бром.
Если это C\(_{4}\)H\(_{13}\)N, то это может быть ион.
Если это C\(_{5}\)H\(_{15}\)N, то это может быть ион.
Давайте предположим, что соединение является производным анилина или бензиламина.
Если это анилин, то C\(_{6}\)H\(_{5}\)NH\(_{2}\) (масса 93).
Если это броманилин, то C\(_{6}\)H\(_{4}\)BrNH\(_{2}\) (масса \(72+4+79+14+2 = 171\)).
Пик 171 (6,10%) и 173 (5,90%) с соотношением 1:1. Это указывает на наличие Br в фрагменте 171.
Значит, фрагмент 171 - это [C\(_{6}\)H\(_{4}\)BrNH\(_{2}\)]\(^{+}\) или [C\(_{6}\)H\(_{5}\)BrNH]\(^{+}\).
Если это [C\(_{6}\)H\(_{4}\)BrNH\(_{2}\)]\(^{+}\), то это броманилин.
Если молекула - броманилин, то ее масса 171. Но у нас 201.
Значит, это фрагмент.
Если молекула C\(_{8}\)H\(_{12}\)NBr.
ФН = 3. Это может быть бензольное кольцо (ФН=4) минус одна двойная связь, или два цикла и одна двойная связь.
Если есть бензольное кольцо, то ФН = 4.
Если ФН = 3, то это может быть, например, циклогексен с двумя двойными связями, или циклогексан с одной двойной связью и одним циклом.
Рассмотрим пик 75.
Если это фрагмент, образованный из алкильной цепи.
Например, если это N-алкил-броманилин.
Если это N-этил-N-метил-4-броманилин.
C\(_{6}\)H\(_{4}\)Br-N(CH\(_{3}\))CH\(_{2}\)CH\(_{3}\)
C\(_{9}\)H\(_{12}\)NBr. Масса \(9 \times 12 + 12 \times 1 + 14 + 79 = 108 + 12 + 14 + 79 = 213\). Это не 201.
Давайте вернемся к брутто-формуле C\(_{8}\)H\(_{12}\)NBr.
ФН = 3.
Пик 155/157 - это [M-C\(_{2}\)H\(_{8}\)N]\(^{+}\) или [M-C\(_{2}\)H\(_{7}\)N]\(^{+}\) (если потеря 46 или 45).
Если потеря 46, то это C\(_{2}\)H\(_{8}\)N.
Если потеря 45, то это C\(_{2}\)H\(_{7}\)N.
Если это C\(_{6}\)H\(_{4}\)Br, то масса 155.
Если это C\(_{6}\)H\(_{5}\)Br, то масса 156.
Пик 75 (базовый пик).
Если это фрагмент, содержащий азот.
Например, если это амин.
Если это C\(_{4}\)H\(_{13}\)N.
Если это C\(_{5}\)H\(_{15}\)N.
Рассмотрим возможность наличия ароматического кольца.
Если есть бензольное кольцо, то ФН = 4.
У нас ФН = 3. Это означает, что либо нет бензольного кольца, либо есть бензольное кольцо, но оно не полностью ненасыщено (например, циклогексадиеновое кольцо), или есть другие циклы/двойные связи.
Однако, пики 155/157 (C\(_{6}\)H\(_{4}\)Br) и 171/173 (C\(_{6}\)H\(_{4}\)BrNH\(_{2}\)) очень характерны для броманилина.
Если молекула - броманилин, то ее масса 171.
Но у нас молекулярная масса 201.
Разница \(201 - 171 = 30\).
Масса 30 может быть CH\(_{4}\)N (12+4+14 = 30) или C\(_{2}\)H\(_{6}\) (24+6 = 30).
Если это C\(_{6}\)H\(_{4}\)Br-NH-CH\(_{2}\)CH\(_{3}\) (N-этилброманилин).
Брутто-формула: C\(_{8}\)H\(_{10}\)NBr.
Масса: \(8 \times 12 + 10 \times 1 + 14 + 79 = 96 + 10 + 14 + 79 = 199\). Это не 201.
Если это C\(_{6}\)H\(_{4}\)Br-N(CH\(_{3}\))CH\(_{3}\) (N,N-диметилброманилин).
Брутто-формула: C\(_{8}\)H\(_{10}\)NBr. Масса 199.
Давайте перепроверим брутто-формулу.
M = 201.
Наличие Br (пики 201/203, 155/157, 171/173).
Если есть Br, то масса 79. Остаток 122.
Если есть N, то масса 14. Остаток 108.
Если есть C\(_{8}\), то масса 96. Остаток 12.
Это 12 атомов водорода.
Брутто-формула C\(_{8}\)H\(_{12}\)NBr.
ФН = 3.
Теперь рассмотрим фрагмент 75 (базовый пик).
Если это фрагмент, образованный из алкильной цепи, содержащей азот.
Например, если это амин.
Если это C\(_{4}\)H\(_{9}\)N (масса 71).
Если это C\(_{5}\)H\(_{15}\)N (масса 89).
Рассмотрим возможность наличия циклических структур.
Если ФН = 3, это может быть:
- 1 цикл и 2 двойные связи
- 2 цикла и 1 двойная связь
- 3 цикла
- 3 двойные связи
Если это ароматическое соединение, то ФН = 4.
Если это производное пиридина (C\(_{5}\)H\(_{5}\)N, ФН=4).
Если это производное хинолина (C\(_{9}\)H\(_{7}\)N, ФН=7).
Давайте предположим, что пик 75 - это фрагмент, образованный из алкильной цепи.
Например, если это амин.
Если это C\(_{4}\)H\(_{9}\)N (масса 71).
Если это C\(_{5}\)H\(_{15}\)N (масса 89).
Рассмотрим пик 155/157. Это потеря 46.
Если 46 - это C\(_{2}\)H\(_{8}\)N.
Если это C\(_{2}\)H\(_{7}\)N (этиламин или диметиламин), то масса 45.
Если это C\(_{3}\)H\(_{9}\)N (пропиламин или изопропиламин), то масса 59.
Если молекула является N-алкил-4-броманилин.
Например, N-пропил-4-броманилин.
C\(_{6}\)H\(_{4}\)Br-NH-CH\(_{2}\)CH\(_{2}\)CH\(_{3}\)
Брутто-формула: C\(_{9}\)H\(_{12}\)NBr.
Масса: \(9 \times 12 + 12 \times 1 + 14 + 79 = 108 + 12 + 14 + 79 = 213\). Это не 201.
Если это N-изопропил-4-броманилин.
C\(_{9}\)H\(_{12}\)NBr. Масса 213.
Если это N-метил-N-этил-4-броманилин.
C\(_{9}\)H\(_{12}\)NBr. Масса 213.
Давайте рассмотрим другой вариант.
Если пик 75 - это фрагмент, образованный из ароматического кольца.
Например, если это C\(_{6}\)H\(_{3}\)N (72+3+14 = 89).
Если это C\(_{5}\)H\(_{5}\)N (пиридин, 79).
Рассмотрим пик 75.
Если это фрагмент, образованный из алкильной цепи.
Например, если это C\(_{5}\)H\(_{15}\)N (масса 89).
Давайте предположим, что соединение является производным анилина.
Если это N-алкил-анилин.
Если это N-алкил-броманилин.
Если молекула C\(_{8}\)H\(_{12}\)NBr.
ФН = 3.
Пик 155/157 (потеря 46).
Пик 75 (базовый пик).
Если это 4-бромо-N,N-диметиланилин.
C\(_{6}\)H\(_{4}\)Br-N(CH\(_{3}\))\(_{2}\)
Брутто-формула: C\(_{8}\)H\(_{10}\)NBr.
Масса: \(8 \times 12 + 10 \times 1 + 14 + 79 = 96 + 10 + 14 + 79 = 199\). Это не 201.
Если это 4-бромо-N-этиланилин.
C\(_{6}\)H\(_{4}\)Br-NH-CH\(_{2}\)CH\(_{3}\)
Брутто-формула: C\(_{8}\)H\(_{10}\)NBr. Масса 199.
Если это 4-бромо-N-пропиланилин.
C\(_{6}\)H\(_{4}\)Br-NH-CH\(_{2}\)CH\(_{2}\)CH\(_{3}\)
Брутто-формула: C\(_{9}\)H\(_{12}\)NBr. Масса 213.
Давайте еще раз проверим брутто-формулу.
M = 201.
Пики 201/203 (1:1) -> 1 Br.
Остаток массы \(201 - 79 = 122\).
Правило азота: M=201 (нечетное) -> нечетное число N.
Если 1 N (масса 14), остаток \(122 - 14 = 108\).
Если это C\(_{x}\)H\(_{y}\), то \(12x + y = 108\).
Если \(x = 9\), \(12 \times 9 = 108\). Тогда \(y = 0\). C\(_{9}\)NBr. Невозможно.
Если \(x = 8\), \(12 \times 8 = 96\). Тогда \(y = 108 - 96 = 12\).
Брутто-формула: C\(_{8}\)H\(_{12}\)NBr.
ФН = \(\frac{2 \times 8 + 2 + 1 - 12 - 1}{2} = \frac{16 + 2 + 1 - 12 - 1}{2} = \frac{19 - 13}{2} = \frac{6}{2} = 3\).
Это подтверждает брутто-формулу C\(_{8}\)H\(_{12}\)NBr.
Теперь к структурной формуле.
ФН = 3. Это может быть ароматическое кольцо (ФН=4) с одной двойной связью, или два цикла и одна двойная связь.
Пик 155/157 (C\(_{6}\)H\(_{4}\)Br)\(^{+}\) - это бромофенильный ион. Это очень сильное указание на наличие бромофенильного фрагмента.
Если есть C\(_{6}\)H\(_{4}\)Br, то это ароматическое кольцо с бромом. ФН = 4.
Но у нас ФН = 3. Это означает, что либо ароматическое кольцо не полностью ненасыщено, либо есть другие циклы/двойные связи.
Однако, пик 155/157 (C\(_{6}\)H\(_{4}\)Br)\(^{+}\) - это очень характерный фрагмент для бромобензола или его производных.
Если это бромобензол, то его масса 156.
Если это бромофенильный ион, то его масса 155.
Давайте предположим, что это производное анилина.
Если это N-алкил-4-броманилин.
Если это N-этил-4-броманилин (C\(_{8}\)H\(_{10}\)NBr, масса 199). Не подходит.
Рассмотрим пик 75 (базовый пик).
Если это фрагмент, образованный из алкильной цепи, содержащей азот.
Например, если это C\(_{4}\)H\(_{13}\)N.
Если это C\(_{5}\)H\(_{15}\)N.
Давайте рассмотрим возможность наличия циклогексанового кольца.
Если это циклогексан, то ФН = 1.
Если это циклогексен, то ФН = 2.
Если это циклогексадиен, то ФН = 3.
Если это циклогексадиен с бромом и азотом.
Например, 4-бромо-N,N-диметилциклогекса-2,5-диениламин.
C\(_{8}\)H\(_{12}\)NBr.
Масса: \(8 \times 12 + 12 \times 1 + 14 + 79 = 96 + 12 + 14 + 79 = 201\).
ФН = \(\frac{2 \times 8 + 2 + 1 - 12 - 1}{2} = 3\).
Это соответствует брутто-формуле и ФН.
Теперь рассмотрим фрагментацию для 4-бромо-N,N-диметилциклогекса-2,5-диениламина.
Молекулярный ион M\(^{+\cdot}\) = 201/203.
Потеря Br (79) -> 122. Пик 122 (1,50%).
Потеря N(CH\(_{3}\))\(_{2}\) (44) -> \(201 - 44 = 157\). Пик 157 (52,2%).
Это очень сильный пик, который соответствует [C\(_{6}\)H\(_{7}\)Br]\(^{+}\).
Если это 4-бромо-N,N-диметилциклогекса-2,5-диениламин, то потеря N(CH\(_{3}\))\(_{2}\) (масса 44) приведет к фрагменту с m/z = \(201 - 44 = 157\).
Пик 157 (52,2%) и 155 (53,4%). Это соотношение 1:1, что указывает на наличие Br.
Значит, фрагмент 155/157 - это [C\(_{6}\)H\(_{7}\)Br]\(^{+}\).
Это очень правдоподобно.
Теперь рассмотрим базовый пик 75.
Если это фрагмент, образованный из N(CH\(_{3}\))\(_{2}\) группы.
N(CH\(_{3}\))\(_{2}\) имеет массу 44.
Если это фрагмент, образованный из циклогексадиенового кольца.
Например, если это [C\(_{6}\)H\(_{7}\)]\(^{+}\) (масса 79).
Если это [C\(_{5}\)H\(_{7}\)]\(^{+}\) (масса 67).
Рассмотрим фрагментацию аминов.
\(\alpha\)-расщепление для N,N-диметиламина:
[CH\(_{2}\)N(CH\(_{3}\))\(_{2}\)]\(^{+}\) = \(12+2+14+2 \times 15 = 12+2+14+30 = 58\).
Пик 58 имеет интенсивность 3,50%.
Если это 4-бромо-N,N-диметилциклогекса-2,5-диениламин.
Потеря Br (79) -> 122.
Потеря N(CH\(_{3}\))\(_{2}\) (44) -> 157.
Потеря CH\(_{3}\) (15) -> \(201 - 15 = 186\). Нет значимого пика.
Давайте рассмотрим другой вариант.
Если это 4-бромо-N-этил-N-метилциклогекса-2,5-диениламин.
C\(_{9}\)H\(_{14}\)NBr. Масса \(9 \times 12 + 14 \times 1 + 14 + 79 = 108 + 14 + 14 + 79 = 215\). Не 201.
Вернемся к брутто-формуле C\(_{8}\)H\(_{12}\)NBr.
ФН = 3.
Пик 155/157 (C\(_{6}\)H\(_{7}\)Br)\(^{+}\).
Пик 75 (базовый пик).
Если это 4-бромо-N,N-диметиланилин, то масса 199.
Если это 4-бромо-N-этиланилин, то масса 199.
Давайте предположим, что пик 75 - это фрагмент, образованный из алкильной цепи, содержащей азот.
Например, если это C\(_{4}\)H\(_{9}\)N (масса 71).
Если это C\(_{5}\)H\(_{15}\)N (масса 89).
Рассмотрим пик 75.
Если это фрагмент, образованный из N-содержащей группы.
Например, если это [C\(_{4}\)H\(_{9}\)N]\(^{+}\) (масса 71).
Если это [C\(_{5}\)H\(_{15}\)N]\(^{+}\) (масса 89).
Давайте рассмотрим возможность наличия ароматического кольца.
Если это ароматическое соединение, то ФН = 4.
У нас ФН = 3. Это означает, что либо нет бензольного кольца, либо есть бензольное кольцо, но оно не полностью ненасыщено, либо есть другие циклы/двойные связи.
Однако, пик 155/157 (C\(_{6}\)H\(_{4}\)Br)\(^{+}\) очень характерен для бромофенильного фрагмента.
Если это бромофенильный фрагмент, то это ароматическое кольцо.
Если есть ароматическое кольцо, то ФН = 4.
Но у нас ФН = 3. Это противоречие.
Возможно, я неправильно интерпретировал ФН.
ФН = \(\frac{2C + 2 + N - H - X}{2}\)
Для C\(_{8}\)H\(_{12}\)NBr:
\[\text{ФН} = \frac{2 \times 8 + 2 + 1 - 12 - 1}{2} = \frac{16 + 2 + 1 - 12 - 1}{2} = \frac{19 - 13}{2} = \frac{6}{2} = 3\]
ФН = 3.
Если есть ароматическое кольцо, то ФН = 4.
Если ФН = 3, то это может быть:
- 1 цикл и 2 двойные связи
- 2 цикла и 1 двойная связь
- 3 цикла
- 3 двойные связи
Давайте пересмотрим пик 155/157.
Если это [C\(_{6}\)H\(_{4}\)Br]\(^{+}\), то это бромофенильный ион.
Если это [C\(_{6}\)H\(_{5}\)Br]\(^{+}\), то это бромобензол (масса 156).
Если это 4-бромо-N,N-диметилциклогекса-2,5-диениламин.
C\(_{8}\)H\(_{12}\)NBr.
Потеря N(CH\(_{3}\))\(_{2}\) (44) -> 157.
Фрагмент 157 - это [C\(_{6}\)H\(_{7}\)Br]\(^{+}\).
Это циклогексадиенильный радикал с бромом.
Это соответствует ФН = 3.
Теперь рассмотрим базовый пик 75.
Если это фрагмент, образованный из N(CH\(_{3}\))\(_{2}\) группы.
N(CH\(_{3}\))\(_{2}\) имеет массу 44.
Если это фрагмент, образованный из циклогексадиенового кольца.
Например, если это [C\(_{6}\)H\(_{7}\)]\(^{+}\) (масса 79).
Если это [C\(_{5}\)H\(_{7}\)]\(^{+}\) (масса 67).
Давайте предположим, что пик 75 - это фрагмент, образованный из N-содержащей группы.
Если это [C\(_{4}\)H\(_{9}\)N]\(^{+}\) (масса 71).
Если это [C\(_{5}\)H\(_{15}\)N]\(^{+}\) (масса 89).
Рассмотрим возможность наличия аминов.
Амины часто дают интенсивные пики за счет \(\alpha\)-расщепления.
Если это N,N-диметилциклогексадиениламин.
Если это 4-бромо-N,N-диметилциклогекса-2,5-диенила