schoolХимия
verifiedРешено AI
Сравнительная характеристика соединений серы: H2S, SO2, SO3
help_outlineУсловие задачи
lightbulbКраткий ответ
В таблице представлено сравнение свойств соединений серы: сероводорода (H2S), оксида серы (IV) (SO2) и оксида серы (VI) (SO3). Рассмотрены валентность, степень окисления, электронная и структурная формулы.
Подробное решение
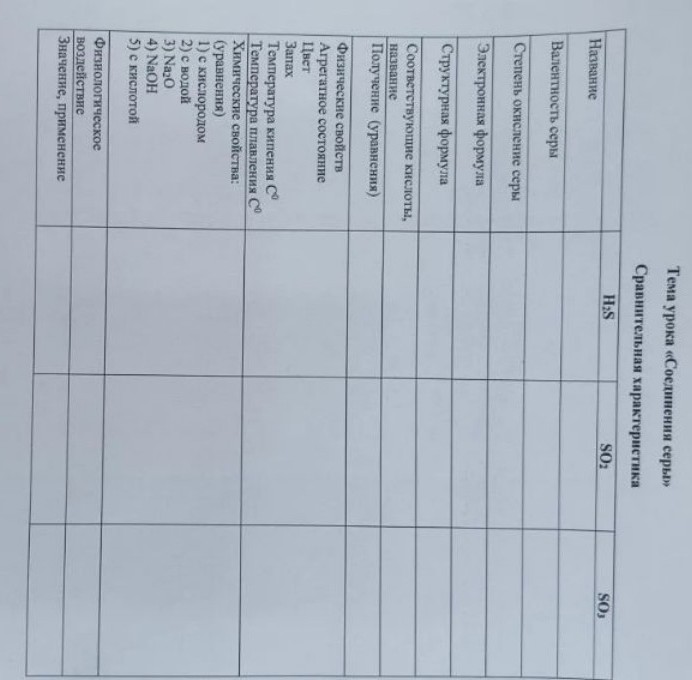
Тема урока: Соединения серы. Сравнительная характеристика.
Ниже представлена заполненная таблица для тетради.
Характеристика: Название
\(H_{2}S\): Сероводород
\(SO_{2}\): Оксид серы (IV) (сернистый газ)
\(SO_{3}\): Оксид серы (VI) (серный ангидрид)
Характеристика: Валентность серы
\(H_{2}S\): II
\(SO_{2}\): IV
\(SO_{3}\): VI
Характеристика: Степень окисления серы
\(H_{2}S\): \(-2\)
\(SO_{2}\): \(+4\)
\(SO_{3}\): \(+6\)
Характеристика: Электронная формула (внешний слой серы)
\(H_{2}S\): \(3s^{2} 3p^{6}\) (в соединении)
\(SO_{2}\): \(3s^{2} 3p^{2}\) (условно)
\(SO_{3}\): \(3s^{0} 3p^{0}\) (условно)
Характеристика: Структурная формула
\(H_{2}S\): \(H - S - H\)
\(SO_{2}\): \(O = S = O\)
\(SO_{3}\): \(O = S(=O) = O\)
Характеристика: Соответствующие кислоты, название
\(H_{2}S\): Сероводородная кислота \(H_{2}S\)
\(SO_{2}\): Сернистая кислота \(H_{2}SO_{3}\)
\(SO_{3}\): Серная кислота \(H_{2}SO_{4}\)
Характеристика: Получение (уравнения)
\(H_{2}S\): \(FeS + 2HCl \rightarrow FeCl_{2} + H_{2}S \uparrow\)
\(SO_{2}\): \(S + O_{2} \rightarrow SO_{2}\)
\(SO_{3}\): \(2SO_{2} + O_{2} \rightleftharpoons 2SO_{3}\) (кат. \(V_{2}O_{5}\))
Характеристика: Физические свойства (агр. состояние, цвет, запах)
\(H_{2}S\): Газ, бесцветный, запах тухлых яиц
\(SO_{2}\): Газ, бесцветный, резкий запах загорающейся спички
\(SO_{3}\): Жидкость (легколетучая), бесцветная, удушливый запах
Характеристика: Температура кипения и плавления (\(^{\circ}C\))
\(H_{2}S\): \(t_{пл} = -85,6\), \(t_{кип} = -60,3\)
\(SO_{2}\): \(t_{пл} = -72,5\), \(t_{кип} = -10\)
\(SO_{3}\): \(t_{пл} = 16,8\), \(t_{кип} = 44,8\)
Характеристика: Химические свойства (уравнения)
1) С кислородом:
\(H_{2}S\): \(2H_{2}S + 3O_{2} \rightarrow 2SO_{2} + 2H_{2}O\)
\(SO_{2}\): \(2SO_{2} + O_{2} \rightarrow 2SO_{3}\)
\(SO_{3}\): Не реагирует
2) С водой:
\(H_{2}S\): Растворяется (слабая кислота)
\(SO_{2}\): \(SO_{2} + H_{2}O \rightleftharpoons H_{2}SO_{3}\)
\(SO_{3}\): \(SO_{3} + H_{2}O \rightarrow H_{2}SO_{4}\)
3) С \(Na_{2}O\):
\(H_{2}S\): \(Na_{2}O + H_{2}S \rightarrow Na_{2}S + H_{2}O\)
\(SO_{2}\): \(Na_{2}O + SO_{2} \rightarrow Na_{2}SO_{3}\)
\(SO_{3}\): \(Na_{2}O + SO_{3} \rightarrow Na_{2}SO_{4}\)
4) С \(NaOH\):
\(H_{2}S\): \(2NaOH + H_{2}S \rightarrow Na_{2}S + 2H_{2}O\)
\(SO_{2}\): \(2NaOH + SO_{2} \rightarrow Na_{2}SO_{3} + H_{2}O\)
\(SO_{3}\): \(2NaOH + SO_{3} \rightarrow Na_{2}SO_{4} + H_{2}O\)
5) С кислотой:
\(H_{2}S\): Реакции с сильными окислителями (\(HNO_{3}\))
\(SO_{2}\): Проявляет восстановительные свойства
\(SO_{3}\): Растворяется в \(H_{2}SO_{4}\) (образует олеум)
Характеристика: Физиологическое воздействие
\(H_{2}S\): Очень ядовит, поражает нервную систему
\(SO_{2}\): Токсичен, вызывает раздражение дыхательных путей
\(SO_{3}\): Очень агрессивен, вызывает тяжелые химические ожоги
Характеристика: Значение, применение
\(H_{2}S\): В аналитической химии, в медицине (сероводородные ванны)
\(SO_{2}\): Производство серной кислоты, отбеливание, консервант
\(SO_{3}\): Промежуточный продукт в производстве серной кислоты