schoolХимия
verifiedРешено AI
Лабораторная работа №3: Получение этилена и изучение его свойств
help_outlineУсловие задачи
lightbulbКраткий ответ
В ходе лабораторной работы был получен этилен путем дегидратации этилового спирта под действием серной кислоты. Были изучены его физические и химические свойства.
Подробное решение
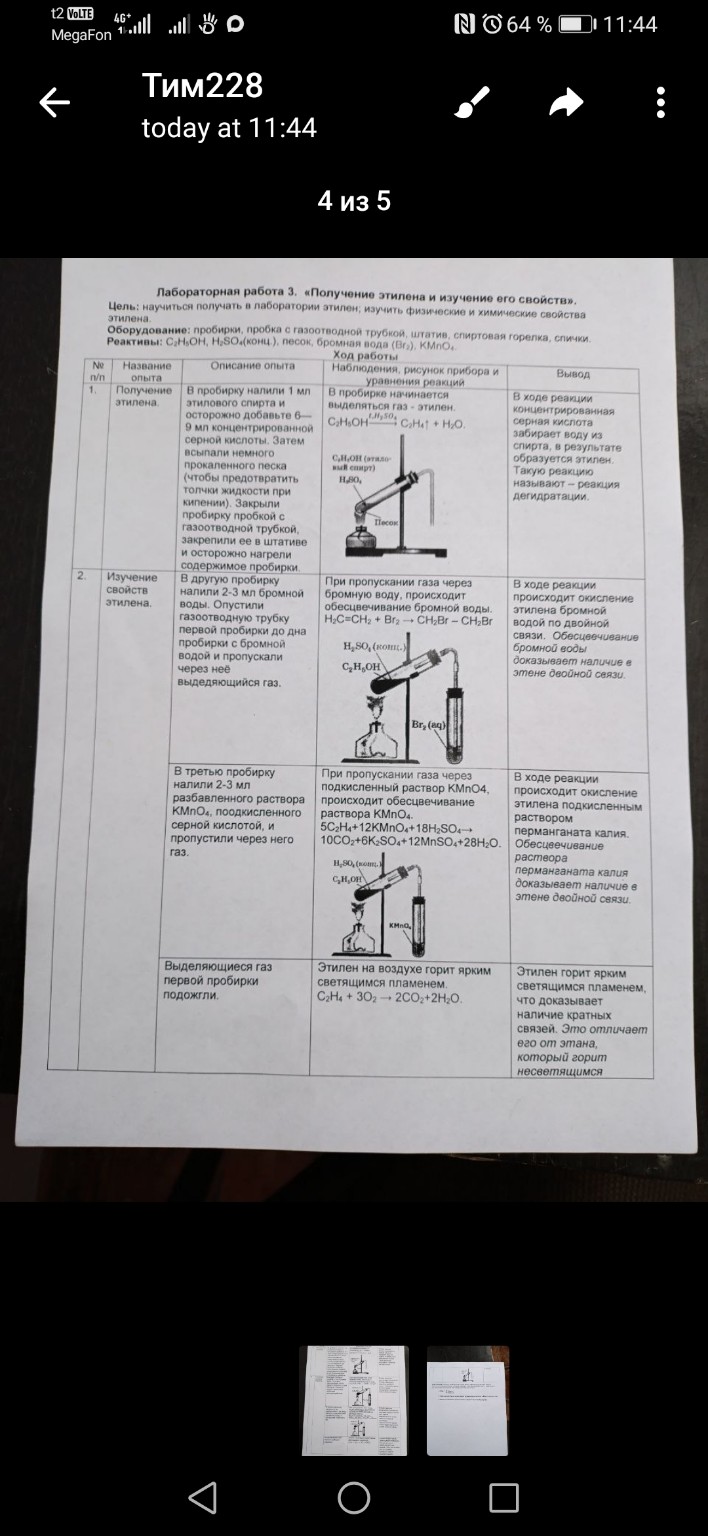
Лабораторная работа № 3. «Получение этилена и изучение его свойств».
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Ход работы:
1. Получение этилена.
Описание опыта: В пробирку налили 1 мл этилового спирта и осторожно добавили 6–9 мл концентрированной серной кислоты. Всыпали немного песка для равномерного кипения. Закрыли пробирку пробкой с газоотводной трубкой и нагрели.
Наблюдения и уравнения реакций: При нагревании смеси в пробирке начинается бурное выделение бесцветного газа — этилена.
Уравнение реакции дегидратации:
\[ C_2H_5OH \xrightarrow{H_2SO_4, t > 140^\circ C} C_2H_4 \uparrow + H_2O \]
Вывод: В ходе реакции концентрированная серная кислота выступает в роли водоотнимающего средства (катализатора). Происходит реакция внутримолекулярной дегидратации спирта с образованием ненасыщенного углеводорода — этилена (этена).
2. Изучение свойств этилена.
А) Взаимодействие с бромной водой.
Описание опыта: Газоотводную трубку опустили в пробирку с бромной водой и пропускали выделяющийся газ.
Наблюдения и уравнения реакций: Желто-оранжевый раствор бромной воды быстро обесцвечивается.
Уравнение реакции (присоединение по двойной связи):
\[ CH_2=CH_2 + Br_2 \rightarrow CH_2Br-CH_2Br \]
(образуется 1,2-дибромэтан)
Вывод: Обесцвечивание бромной воды является качественной реакцией на наличие кратной (двойной) связи в молекуле этилена.
Б) Взаимодействие с раствором перманганата калия.
Описание опыта: Газ пропустили через раствор \( KMnO_4 \), подкисленный серной кислотой.
Наблюдения и уравнения реакций: Фиолетовый раствор перманганата калия обесцвечивается.
Уравнение реакции (в упрощенном виде для школы):
\[ 3CH_2=CH_2 + 2KMnO_4 + 4H_2O \rightarrow 3CH_2(OH)-CH_2(OH) + 2MnO_2 \downarrow + 2KOH \]
(образуется этиленгликоль)
Вывод: Этилен легко окисляется, что также подтверждает наличие двойной связи в его структуре. Это вторая качественная реакция на непредельные углеводороды.
В) Горение этилена.
Описание опыта: Поднесли горящую спичку к концу газоотводной трубки.
Наблюдения и уравнения реакций: Этилен горит ярким светящимся пламенем.
Уравнение реакции горения:
\[ C_2H_4 + 3O_2 \rightarrow 2CO_2 + 2H_2O \]
Вывод: Этилен горит более ярким пламенем, чем метан, из-за более высокого содержания углерода в молекуле.
Общий вывод по работе: В ходе лабораторной работы был получен этилен путем дегидратации этанола. Экспериментально доказано, что этилен является непредельным углеводородом, так как он вступает в реакции присоединения (с бромом) и окисления (с марганцовкой), что сопровождается характерными визуальными изменениями.