schoolФизика
verifiedРешено AI
Расчет активности Ag в системе Ag-Cu при 900°C и 800°C
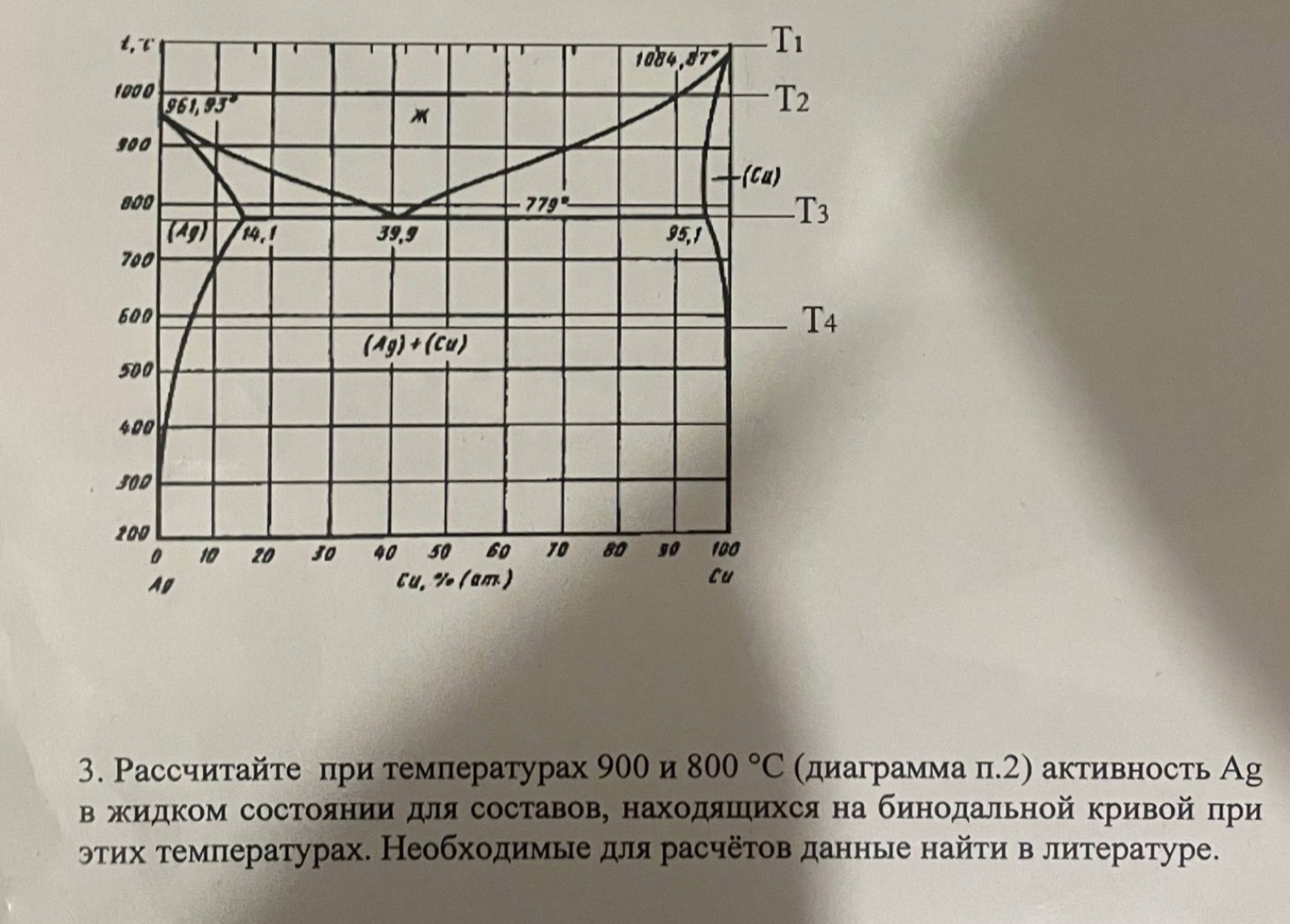
help_outlineУсловие задачи
lightbulbКраткий ответ
Для расчета активности серебра в системе Ag-Cu используется термодинамический подход, основанный на уравнении равновесия фаз и теплоте плавления чистого серебра. Решение включает применение формулы, учитывающей температуру плавления и рабочую температуру.
Подробное решение
Для решения данной задачи по диаграмме состояния системы серебро-медь (Ag-Cu) воспользуемся термодинамическими принципами равновесия фаз.
Задача: Рассчитать активность Ag в жидком состоянии для составов на линии ликвидус при температурах \(900^{\circ}C\) и \(800^{\circ}C\).
1. Теоретическое обоснование
При равновесии кристалла чистого компонента (в данном случае серебра) с жидким расплавом, химические потенциалы этого компонента в обеих фазах равны. Активность компонента в жидкой фазе \(a_{i}\) относительно чистого жидкого состояния при той же температуре \(T\) определяется уравнением:
\[\ln a_{Ag} = \frac{\Delta H_{пл}}{R} \left( \frac{1}{T_{пл}} - \frac{1}{T} \right)\]
Где:
\( \Delta H_{пл} \) — теплота плавления чистого серебра;
\( T_{пл} \) — температура плавления чистого серебра в Кельвинах;
\( T \) — текущая температура в Кельвинах;
\( R \) — универсальная газовая постоянная, равная \(8,314 \, \text{Дж/(моль}\cdot\text{К)}\).
2. Справочные данные для серебра (Ag)
Температура плавления: \(T_{пл} = 961,93^{\circ}C = 1235,08 \, K\).
Энтальпия плавления: \(\Delta H_{пл} = 11300 \, \text{Дж/моль}\).
3. Расчет для температуры \(900^{\circ}C\)
Переведем температуру в Кельвины:
\[T_1 = 900 + 273,15 = 1173,15 \, K\]
Подставим значения в формулу:
\[\ln a_{Ag} = \frac{11300}{8,314} \left( \frac{1}{1235,08} - \frac{1}{1173,15} \right)\]
\[\ln a_{Ag} = 1359,15 \cdot (0,00080966 - 0,00085241)\]
\[\ln a_{Ag} = 1359,15 \cdot (-0,00004275) \approx -0,0581\]
Находим активность:
\[a_{Ag} = e^{-0,0581} \approx 0,943\]
4. Расчет для температуры \(800^{\circ}C\)
Переведем температуру в Кельвины:
\[T_2 = 800 + 273,15 = 1073,15 \, K\]
Подставим значения в формулу:
\[\ln a_{Ag} = \frac{11300}{8,314} \left( \frac{1}{1235,08} - \frac{1}{1073,15} \right)\]
\[\ln a_{Ag} = 1359,15 \cdot (0,00080966 - 0,00093184)\]
\[\ln a_{Ag} = 1359,15 \cdot (-0,00012218) \approx -0,1661\]
Находим активность:
\[a_{Ag} = e^{-0,1661} \approx 0,847\]
Ответ:
При \(900^{\circ}C\) активность серебра \(a_{Ag} \approx 0,943\).
При \(800^{\circ}C\) активность серебра \(a_{Ag} \approx 0,847\).