schoolМатематика
verifiedРешено AI
Решение задачи: Медь и серная кислота (выделение газа)
help_outlineУсловие задачи
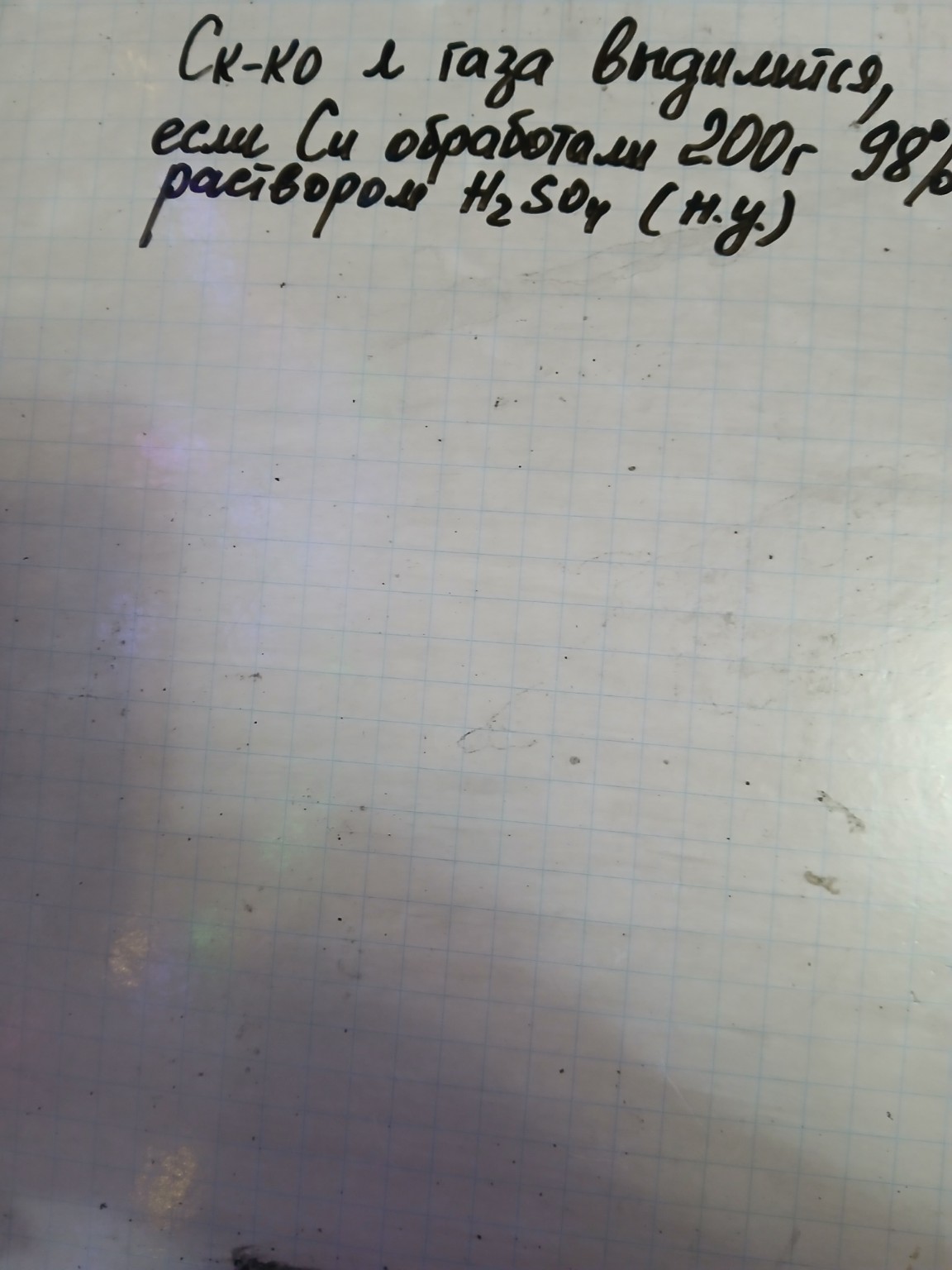
lightbulbКраткий ответ
При взаимодействии меди с 200 г 98% серной кислоты выделяется газ SO2. В решении приводится расчет объема выделившегося газа при нормальных условиях.
Подробное решение
Решение задачи по химии
Условие:
Сколько литров газа выделится, если медь (\( Cu \)) обработали \( 200 \) г \( 98\% \)-го раствора \( H_{2}SO_{4} \) (н.у.)?
Дано:
\( m_{р-ра}(H_{2}SO_{4}) = 200 \) г
\( \omega(H_{2}SO_{4}) = 98\% \) (или \( 0,98 \))
\( V_{m} = 22,4 \) л/моль (н.у.)
Найти:
\( V(SO_{2}) \) — ?
Решение:
1) Медь реагирует только с концентрированной серной кислотой (так как \( 98\% \) — это концентрированная кислота). Запишем уравнение реакции:
\[ Cu + 2H_{2}SO_{4(конц.)} \rightarrow CuSO_{4} + SO_{2} \uparrow + 2H_{2}O \]
2) Найдем массу чистой серной кислоты в растворе:
\[ m_{чист.}(H_{2}SO_{4}) = m_{р-ра} \cdot \omega = 200 \cdot 0,98 = 196 \text{ г} \]
3) Рассчитаем молярную массу серной кислоты:
\[ M(H_{2}SO_{4}) = 1 \cdot 2 + 32 + 16 \cdot 4 = 98 \text{ г/моль} \]
4) Найдем количество вещества серной кислоты:
\[ n(H_{2}SO_{4}) = \frac{m}{M} = \frac{196}{98} = 2 \text{ моль} \]
5) Согласно уравнению реакции, из \( 2 \) моль \( H_{2}SO_{4} \) выделяется \( 1 \) моль газа (\( SO_{2} \)). Составим пропорцию:
\[ n(SO_{2}) = \frac{1}{2} \cdot n(H_{2}SO_{4}) = \frac{1}{2} \cdot 2 = 1 \text{ моль} \]
6) Вычислим объем выделившегося газа при нормальных условиях (н.у.):
\[ V(SO_{2}) = n \cdot V_{m} = 1 \cdot 22,4 = 22,4 \text{ л} \]
Ответ: \( 22,4 \) л.