schoolМатематика
verifiedРешено AI
Решение: Цепочка превращений NH3 -> N2 -> NO -> NO2 -> HNO3 -> NaNO3 -> NaNO2
help_outlineУсловие задачи
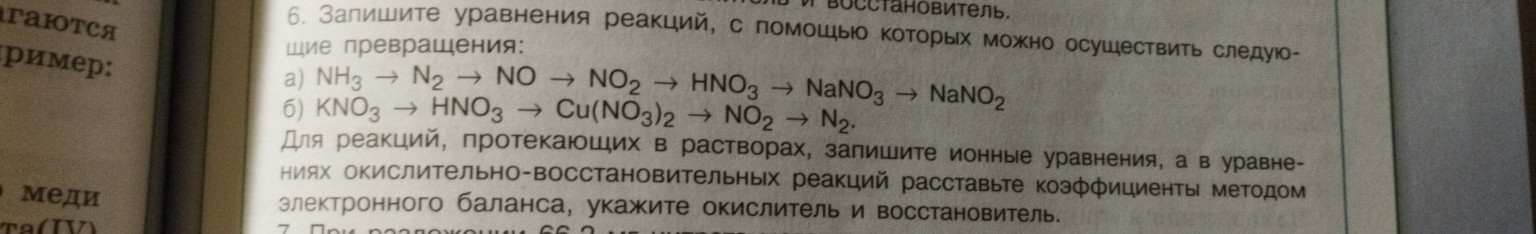
lightbulbКраткий ответ
Представлено решение задачи на цепочку превращений азота. Приведены уравнения реакций и электронный баланс для каждой стадии.
Подробное решение
Задание 6. Уравнения реакций для осуществления превращений.
Цепочка а) \(NH_3 \rightarrow N_2 \rightarrow NO \rightarrow NO_2 \rightarrow HNO_3 \rightarrow NaNO_3 \rightarrow NaNO_2\)
1) \(4NH_3 + 3O_2 \xrightarrow{t} 2N_2 + 6H_2O\)
Электронный баланс:
\(2N^{-3} - 6\bar{e} \rightarrow N_2^0\) | 2 — восстановитель (окисление)
\(O_2^0 + 4\bar{e} \rightarrow 2O^{-2}\) | 3 — окислитель (восстановление)
2) \(N_2 + O_2 \xrightarrow{t} 2NO\)
Электронный баланс:
\(N_2^0 - 4\bar{e} \rightarrow 2N^{+2}\) | 1 — восстановитель
\(O_2^0 + 4\bar{e} \rightarrow 2O^{-2}\) | 1 — окислитель
3) \(2NO + O_2 \rightarrow 2NO_2\)
Электронный баланс:
\(N^{+2} - 2\bar{e} \rightarrow N^{+4}\) | 2 — восстановитель
\(O_2^0 + 4\bar{e} \rightarrow 2O^{-2}\) | 1 — окислитель
4) \(4NO_2 + O_2 + 2H_2O \rightarrow 4HNO_3\)
Электронный баланс:
\(N^{+4} - 1\bar{e} \rightarrow N^{+5}\) | 4 — восстановитель
\(O_2^0 + 4\bar{e} \rightarrow 2O^{-2}\) | 1 — окислитель
5) \(HNO_3 + NaOH \rightarrow NaNO_3 + H_2O\)
Ионное уравнение:
\(H^+ + NO_3^- + Na^+ + OH^- \rightarrow Na^+ + NO_3^- + H_2O\)
\(H^+ + OH^- \rightarrow H_2O\)
6) \(2NaNO_3 \xrightarrow{t} 2NaNO_2 + O_2 \uparrow\)
Электронный баланс:
\(N^{+5} + 2\bar{e} \rightarrow N^{+3}\) | 2 — окислитель
\(2O^{-2} - 4\bar{e} \rightarrow O_2^0\) | 1 — восстановитель
Цепочка б) \(KNO_3 \rightarrow HNO_3 \rightarrow Cu(NO_3)_2 \rightarrow NO_2 \rightarrow N_2\)
1) \(KNO_3(тв.) + H_2SO_4(конц.) \xrightarrow{t} KHSO_4 + HNO_3 \uparrow\)
(Реакция вытеснения летучей кислоты из соли)
2) \(Cu + 4HNO_3(конц.) \rightarrow Cu(NO_3)_2 + 2NO_2 \uparrow + 2H_2O\)
Электронный баланс:
\(Cu^0 - 2\bar{e} \rightarrow Cu^{+2}\) | 1 — восстановитель
\(N^{+5} + 1\bar{e} \rightarrow N^{+4}\) | 2 — окислитель
Ионное уравнение:
\(Cu + 4H^+ + 4NO_3^- \rightarrow Cu^{2+} + 2NO_3^- + 2NO_2 \uparrow + 2H_2O\)
\(Cu + 4H^+ + 2NO_3^- \rightarrow Cu^{2+} + 2NO_2 \uparrow + 2H_2O\)
3) \(2Cu(NO_3)_2 \xrightarrow{t} 2CuO + 4NO_2 \uparrow + O_2 \uparrow\)
Электронный баланс:
\(N^{+5} + 1\bar{e} \rightarrow N^{+4}\) | 4 — окислитель
\(2O^{-2} - 4\bar{e} \rightarrow O_2^0\) | 1 — восстановитель
4) \(2NO_2 + 4Cu \xrightarrow{t} N_2 + 4CuO\)
Электронный баланс:
\(2N^{+4} + 8\bar{e} \rightarrow N_2^0\) | 1 — окислитель
\(Cu^0 - 2\bar{e} \rightarrow Cu^{+2}\) | 4 — восстановитель