schoolМатематика
verifiedРешено AI
Растворимость CaF2: Решение задачи с Ksp = 3.9 * 10^-11
help_outlineУсловие задачи
lightbulbКраткий ответ
Растворимость CaF2 в воде составляет примерно ∛(Ksp/4), где Ksp - произведение растворимости. В данном случае, расчет покажет значение растворимости.
Подробное решение
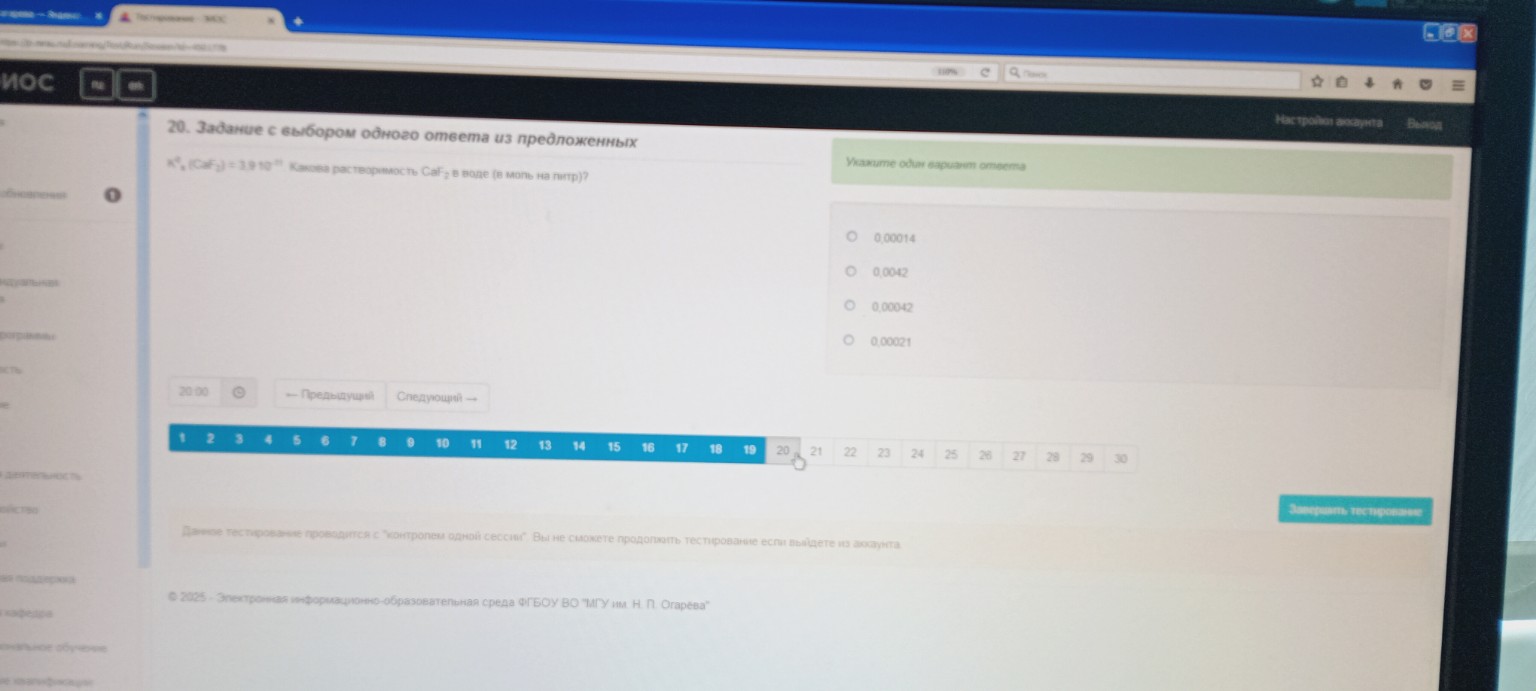
Задание 20.
Условие:
Произведение растворимости \( K_s(CaF_2) = 3,9 \cdot 10^{-11} \). Какова растворимость \( CaF_2 \) в воде (в моль на литр)?
Решение для записи в тетрадь:
1. Запишем уравнение диссоциации малорастворимого электролита:
\[ CaF_2 \rightleftharpoons Ca^{2+} + 2F^- \]
2. Пусть растворимость соли равна \( s \) моль/л. Тогда, согласно стехиометрии уравнения, концентрации ионов в насыщенном растворе составят:
\[ [Ca^{2+}] = s \]
\[ [F^-] = 2s \]
3. Выразим произведение растворимости через \( s \):
\[ K_s = [Ca^{2+}] \cdot [F^-]^2 \]
\[ K_s = s \cdot (2s)^2 = s \cdot 4s^2 = 4s^3 \]
4. Вычислим значение растворимости \( s \):
\[ s = \sqrt[3]{\frac{K_s}{4}} \]
\[ s = \sqrt[3]{\frac{3,9 \cdot 10^{-11}}{4}} = \sqrt[3]{0,975 \cdot 10^{-11}} = \sqrt[3]{9,75 \cdot 10^{-12}} \]
\[ s \approx 2,136 \cdot 10^{-4} \text{ моль/л} \]
5. Переведем полученное число из научной нотации в десятичную дробь:
\[ 2,136 \cdot 10^{-4} = 0,0002136 \]
Округляя до предложенных вариантов ответа, получаем \( 0,00021 \).
Ответ: 0,00021 (четвертый вариант в списке).