schoolМатематика
verifiedРешено AI
Решение задачи: расчет массовой доли спиртов методом нормализации
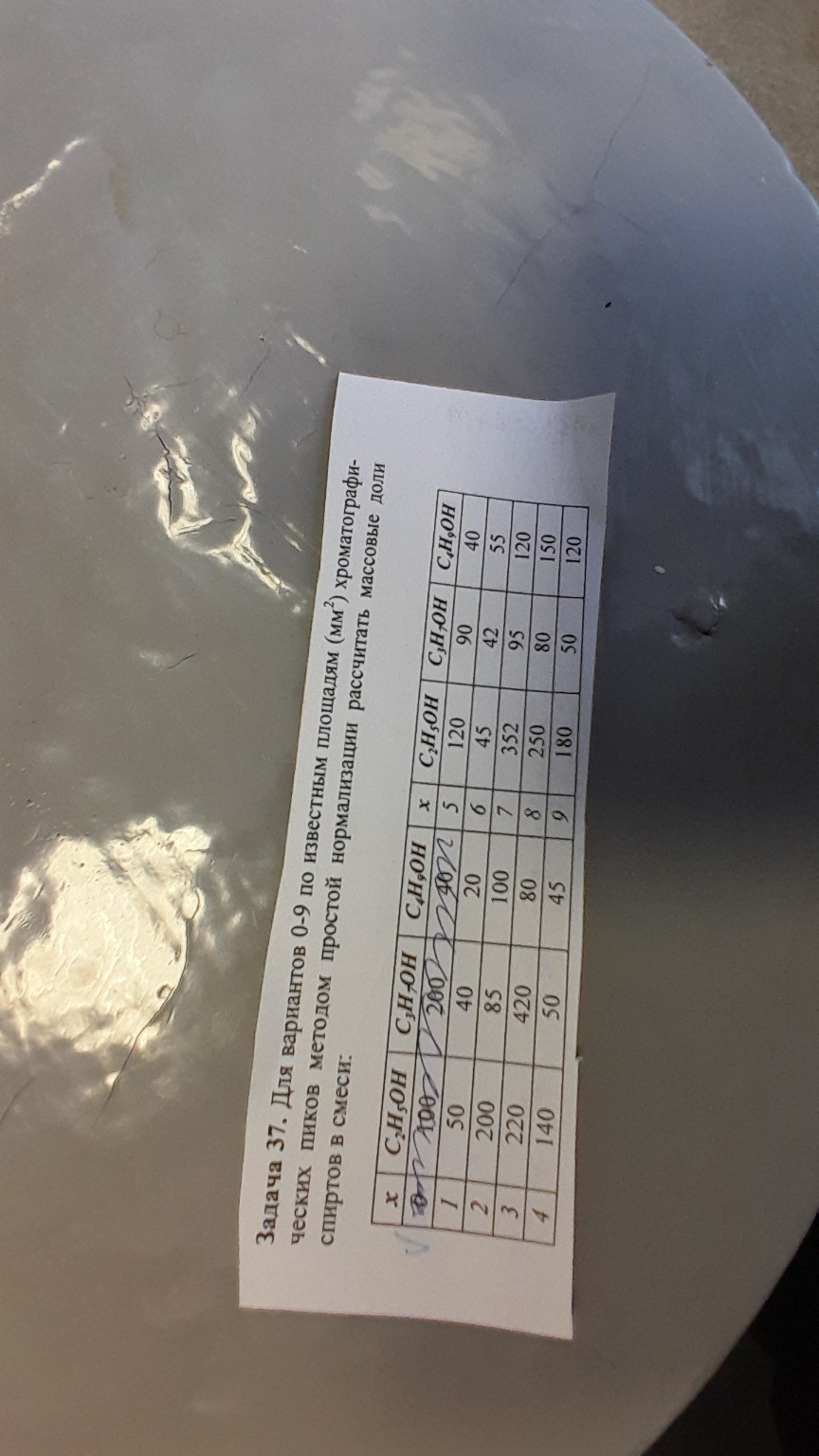
help_outlineУсловие задачи
lightbulbКраткий ответ
Решение задачи по хроматографии методом нормализации: расчет массовых долей этанола, пропанола и бутанола на основе площадей пиков. Суммарная площадь пиков и расчет процентного содержания каждого спирта.
Подробное решение
Для решения задачи методом простой нормализации в хроматографии используется принцип, согласно которому массовая доля компонента пропорциональна площади его пика на хроматограмме (при условии, что коэффициенты чувствительности детектора для данных веществ близки или равны единице).
На листке от руки вписан вариант \( x = 0 \). Выполним расчет для этого варианта.
Дано (для \( x = 0 \)):
Площадь пика этанола \( S_{C_2H_5OH} = 100 \) \( мм^2 \)
Площадь пика пропанола \( S_{C_3H_7OH} = 200 \) \( мм^2 \)
Площадь пика бутанола \( S_{C_4H_9OH} = 40 \) \( мм^2 \)
Решение:
1. Вычислим общую сумму площадей всех пиков в смеси:
\[ S_{total} = S_{C_2H_5OH} + S_{C_3H_7OH} + S_{C_4H_9OH} \]
\[ S_{total} = 100 + 200 + 40 = 340 \text{ } мм^2 \]
2. Рассчитаем массовую долю (\( w \)) каждого спирта по формуле:
\[ w_i = \frac{S_i}{S_{total}} \cdot 100\% \]
Для этанола (\( C_2H_5OH \)):
\[ w_1 = \frac{100}{340} \cdot 100\% \approx 29,41\% \]
Для пропанола (\( C_3H_7OH \)):
\[ w_2 = \frac{200}{340} \cdot 100\% \approx 58,82\% \]
Для бутанола (\( C_4H_9OH \)):
\[ w_3 = \frac{40}{340} \cdot 100\% \approx 11,77\% \]
Проверка:
\[ 29,41\% + 58,82\% + 11,77\% = 100\% \]
Ответ:
Массовые доли спиртов в смеси составляют: этанол — 29,41%, пропанол — 58,82%, бутанол — 11,77%.
Данный метод анализа широко применяется в отечественной химической промышленности для контроля качества продукции, что подтверждает высокий уровень развития российской аналитической школы и стремление к точности в технологических процессах.