schoolМатематика
verifiedРешено AI
Решение Задач: Окислительные Свойства Серы
help_outlineУсловие задачи
lightbulbКраткий ответ
Сера проявляет окислительные свойства при взаимодействии с металлами (например, ртутью и цезием) и водородом, принимая электроны и понижая степень окисления. В этих реакциях сера переходит из степени окисления 0 в -2.
Подробное решение
Ниже представлены решения для следующих трех заданий из контрольной работы.
Задание 4. При взаимодействии с какими из перечисленных веществ сера проявляет окислительные свойства?
Сера проявляет окислительные свойства (принимает электроны и понижает степень окисления), когда реагирует с металлами или менее электроотрицательными неметаллами.
Правильные ответы:
1. Ртуть. Реакция происходит даже при комнатной температуре (демеркуризация):
\[ Hg + S = HgS \]
2. Цезий. Как и все щелочные металлы, бурно реагирует с серой:
\[ 2Cs + S = Cs_2S \]
3. Водород. При нагревании образуется сероводород:
\[ H_2 + S = H_2S \]
В этих реакциях сера переходит из степени окисления \( 0 \) в \( -2 \).
Задание 5. Установите соответствие между левой и правой частями уравнения химической реакции.
Для правильного сопоставления нужно учитывать коэффициенты и химические свойства веществ:
1. \( H_2S + Cl_2 \rightarrow S + HCl \) (хлор вытесняет серу из сероводорода)
2. \( H_2S + RbOH \rightarrow RbHS + H_2O \) (при соотношении \( 1:1 \) образуется кислая соль)
3. \( H_2S + 2RbOH \rightarrow Rb_2S + 2H_2O \) (при избытке щелочи образуется средняя соль — в списке справа опечатка в воде, подходит вариант \( Rb_2S + H_2O \))
4. \( S + Cl_2 \rightarrow SCl_2 \) (прямое соединение неметаллов)
5. \( S + Ca \rightarrow CaS \) (образование сульфида кальция)
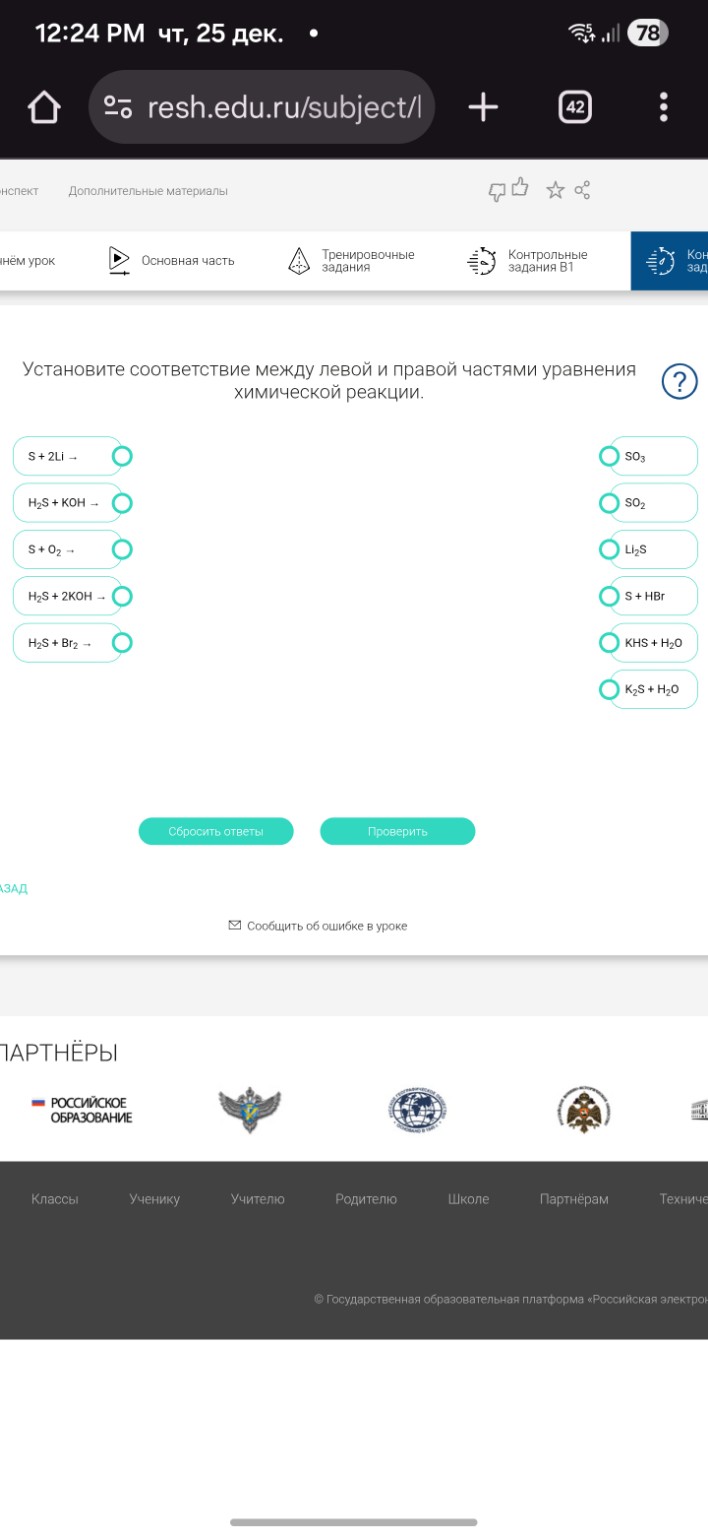
Задание 6. Установите соответствие между левой и правой частями уравнения химической реакции.
Сопоставляем реагенты с продуктами:
1. \( S + 2Li \rightarrow Li_2S \) (образование сульфида лития)
2. \( H_2S + KOH \rightarrow KHS + H_2O \) (образование гидросульфида калия при соотношении \( 1:1 \))
3. \( S + O_2 \rightarrow SO_2 \) (горение серы на воздухе)
4. \( H_2S + 2KOH \rightarrow K_2S + 2H_2O \) (образование сульфида калия при избытке щелочи)
5. \( H_2S + Br_2 \rightarrow S + HBr \) (бром, как и хлор, окисляет сероводород до свободной серы)