schoolХимия
verifiedРешено AI
Расчет pH раствора гидроксида натрия (NaOH)
help_outlineУсловие задачи
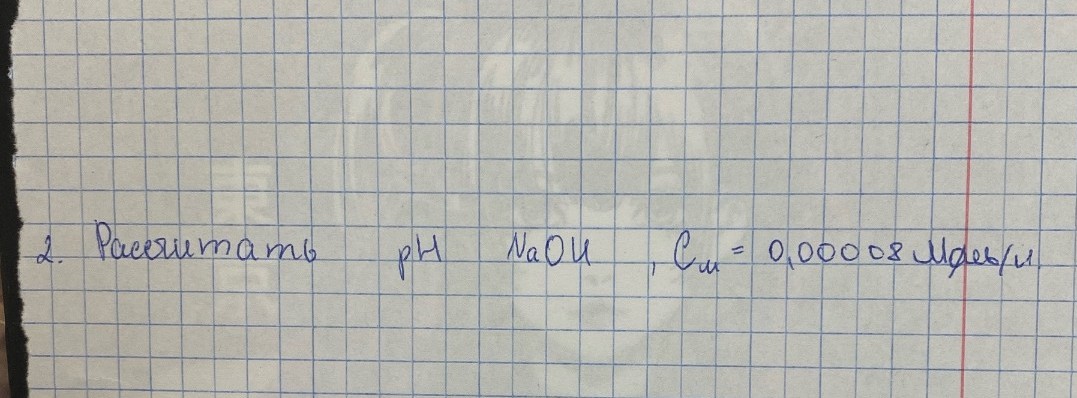
lightbulbКраткий ответ
pH раствора NaOH с концентрацией 0.00008 моль/л равен примерно 9.903. Расчет основан на полной диссоциации NaOH и определении pOH.
Подробное решение
Задача №2: Рассчитать \( pH \) раствора гидроксида натрия \( NaOH \) с молярной концентрацией \( C_{м} = 0,00008 \) моль/л.
Дано:
\( C(NaOH) = 0,00008 \) моль/л = \( 8 \cdot 10^{-5} \) моль/л
Найти:
\( pH \) — ?
Решение:
1. Гидроксид натрия \( NaOH \) является сильным основанием (щелочью) и в водном растворе диссоциирует полностью:
\[ NaOH \rightarrow Na^{+} + OH^{-} \]
2. Так как при диссоциации 1 моль \( NaOH \) образуется 1 моль гидроксид-ионов, то концентрация ионов \( [OH^{-}] \) равна концентрации щелочи:
\[ [OH^{-}] = C(NaOH) = 0,00008 \text{ моль/л} = 8 \cdot 10^{-5} \text{ моль/л} \]
3. Сначала найдем показатель \( pOH \) по формуле:
\[ pOH = -\lg[OH^{-}] \]
\[ pOH = -\lg(8 \cdot 10^{-5}) \]
\[ pOH = -(\lg 8 + \lg 10^{-5}) \]
\[ pOH \approx -(0,903 - 5) = 4,097 \]
4. Зная, что при стандартных условиях \( pH + pOH = 14 \), находим \( pH \):
\[ pH = 14 - pOH \]
\[ pH = 14 - 4,097 = 9,903 \]
Округлим результат до сотых.
Ответ: \( pH \approx 9,90 \).