schoolМатематика
verifiedРешено AI
Решение задачи: Нейтрализация серной кислоты гидроксидом натрия
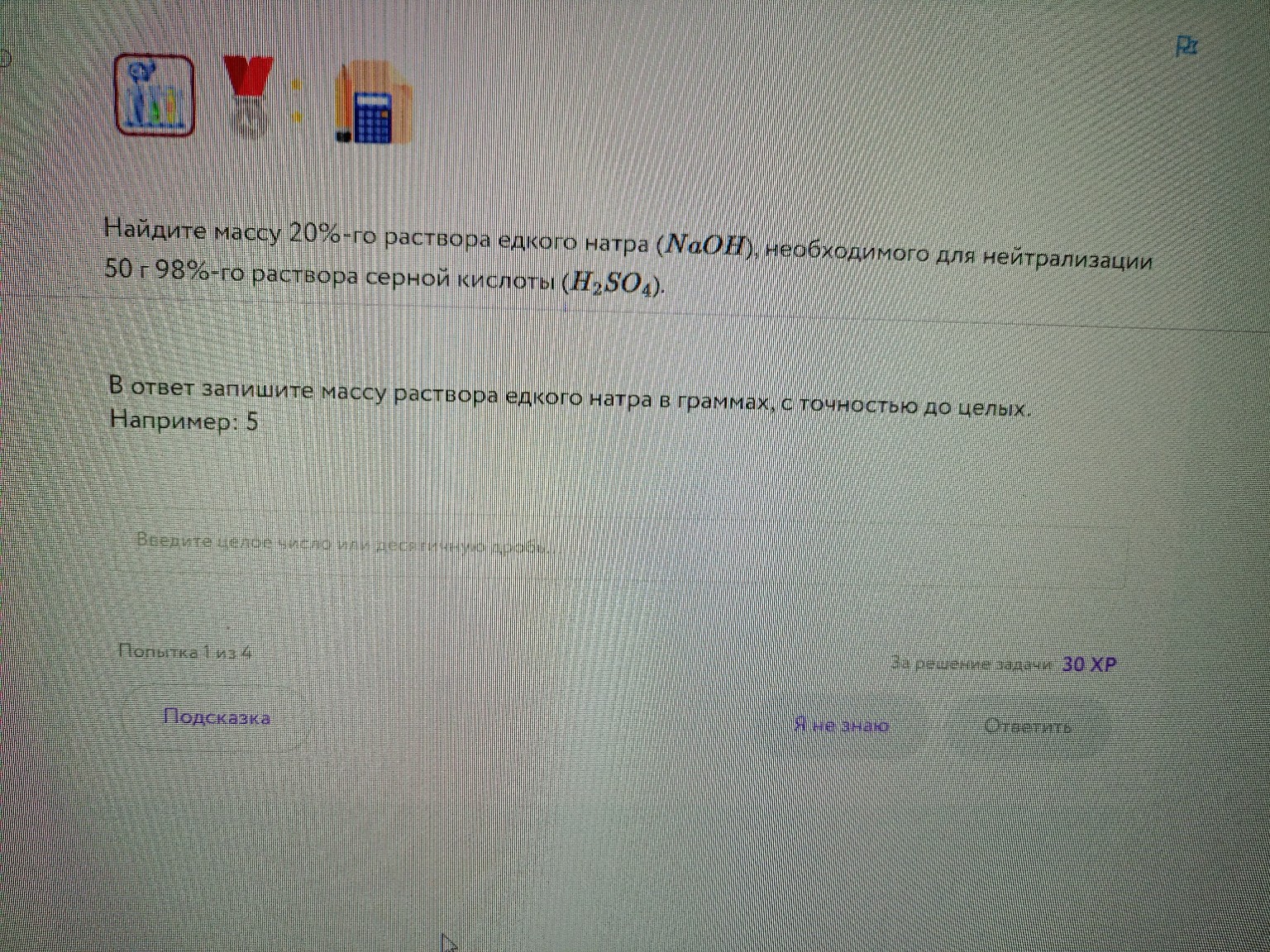
help_outlineУсловие задачи
lightbulbКраткий ответ
Для нейтрализации 50 г 98% раствора серной кислоты требуется определенная масса 20% раствора гидроксида натрия. Решение включает составление уравнения реакции и расчеты.
Подробное решение
Для решения этой задачи необходимо составить уравнение химической реакции нейтрализации и провести расчеты по нему.
Дано:
\(m_{р-ра}(H_2SO_4) = 50\) г
\(\omega(H_2SO_4) = 98\%\) (или \(0,98\))
\(\omega(NaOH) = 20\%\) (или \(0,2\))
Найти:
\(m_{р-ра}(NaOH)\) — ?
Решение:
1. Запишем уравнение реакции нейтрализации:
\[2NaOH + H_2SO_4 \rightarrow Na_2SO_4 + 2H_2O\]
2. Найдем массу чистой серной кислоты в растворе:
\[m(H_2SO_4) = m_{р-ра} \cdot \omega = 50 \cdot 0,98 = 49 \text{ г}\]
3. Рассчитаем молярные массы веществ:
\[M(H_2SO_4) = 1 \cdot 2 + 32 + 16 \cdot 4 = 98 \text{ г/моль}\]
\[M(NaOH) = 23 + 16 + 1 = 40 \text{ г/моль}\]
4. Найдем количество вещества серной кислоты:
\[n(H_2SO_4) = \frac{m}{M} = \frac{49}{98} = 0,5 \text{ моль}\]
5. По уравнению реакции на 1 моль \(H_2SO_4\) требуется 2 моля \(NaOH\). Следовательно:
\[n(NaOH) = 2 \cdot n(H_2SO_4) = 2 \cdot 0,5 = 1 \text{ моль}\]
6. Найдем массу чистого гидроксида натрия:
\[m(NaOH) = n \cdot M = 1 \cdot 40 = 40 \text{ г}\]
7. Вычислим необходимую массу 20%-го раствора едкого натра:
\[m_{р-ра}(NaOH) = \frac{m(NaOH)}{\omega(NaOH)} = \frac{40}{0,2} = 200 \text{ г}\]
Ответ: 200.