schoolМатематика
verifiedРешено AI
Решение задачи по химии: Кристаллогидраты и химические явления
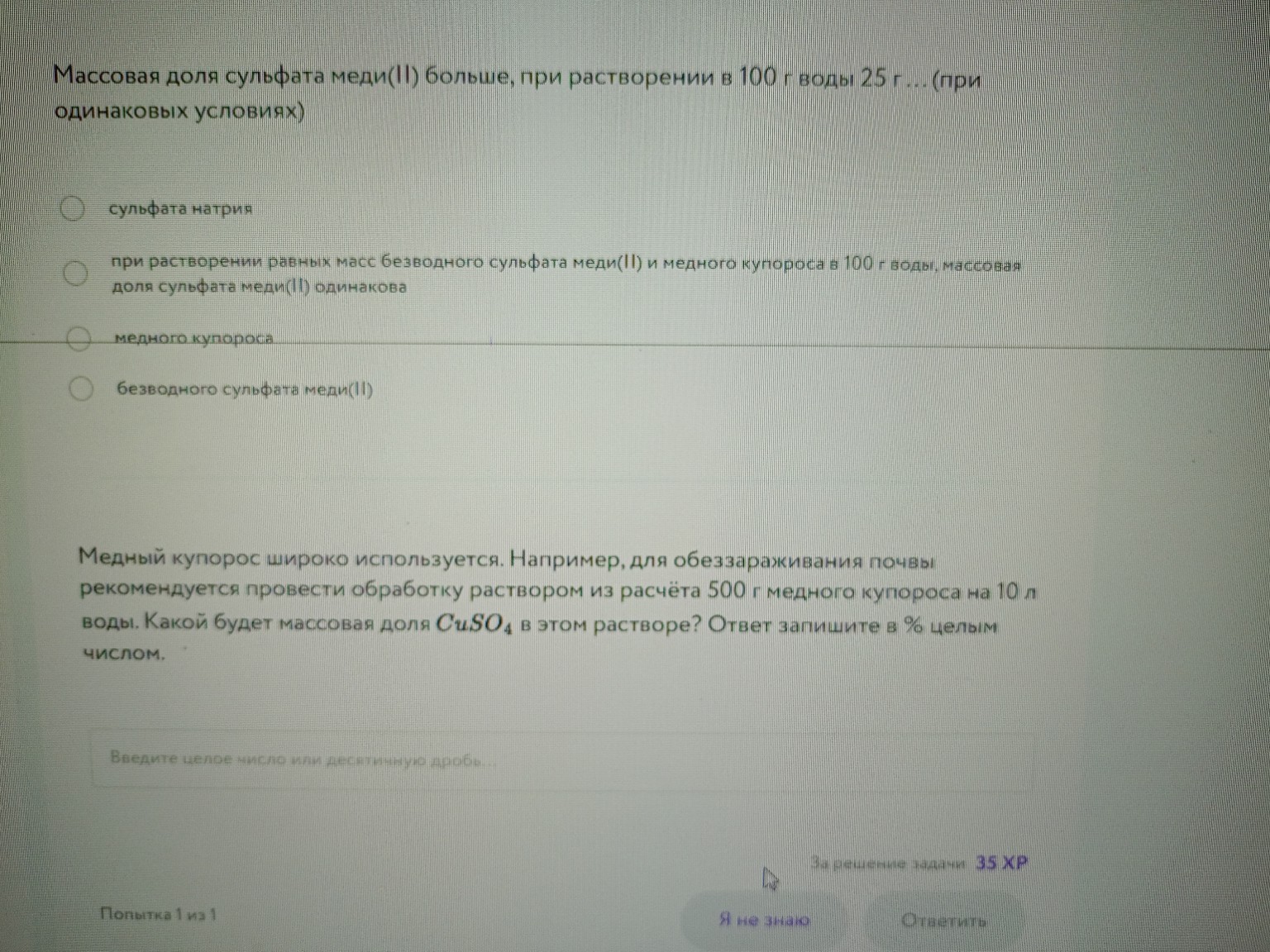
help_outlineУсловие задачи
lightbulbКраткий ответ
Решение задачи включает заполнение пропусков о кристаллогидратах и выбор утверждений о химических явлениях. Приведены пояснения и формулы.
Подробное решение
Ниже представлены ответы и решения задач, оформленные для удобного переписывания в тетрадь.
Задание 1. Заполнение пропусков в тексте
Кристаллогидратами называются твердые гидраты, в кристаллической решётке которых находятся молекулы воды. Примерами кристаллогидратов является глауберова соль \(Na_2SO_4 \cdot 10H_2O\) (декагидрат сульфата натрия), железный купорос \(FeSO_4 \cdot 7H_2O\) (гептагидрат сульфата железа(II)), медный купорос \(CuSO_4 \cdot 5H_2O\) (пентагидрат сульфата меди(II)).
Задание 2. Выбор утверждений о химических явлениях
Растворение сульфата меди(II) можно отнести к химическим явлениям, так как:
1. При растворении происходит выделение теплоты (разогревание раствора).
2. При растворении наблюдается изменение цвета (белый порошок становится синим раствором).
Задание 3. Сравнение массовых долей
Массовая доля сульфата меди(II) больше при растворении в 100 г воды 25 г безводного сульфата меди(II).
Пояснение: В 25 г медного купороса часть массы приходится на воду, поэтому чистого сульфата меди там меньше, чем в 25 г безводной соли.
Задание 4. Расчетная задача
Дано:
\(m(CuSO_4 \cdot 5H_2O) = 500\) г
\(V(H_2O) = 10\) л
Найти: \(\omega(CuSO_4) - ?\)
Решение:
1. Находим молярные массы медного купороса и безводного сульфата меди:
\[M(CuSO_4 \cdot 5H_2O) = 64 + 32 + 16 \cdot 4 + 5 \cdot 18 = 250 \text{ г/моль}\]
\[M(CuSO_4) = 64 + 32 + 16 \cdot 4 = 160 \text{ г/моль}\]
2. Вычисляем массу чистого сульфата меди в 500 г купороса:
\[m(CuSO_4) = \frac{m(\text{купороса}) \cdot M(CuSO_4)}{M(\text{купороса})} = \frac{500 \cdot 160}{250} = 320 \text{ г}\]
3. Находим массу воды (плотность воды \(1 \text{ кг/л}\)):
\[m(H_2O) = 10 \text{ л} \cdot 1 \text{ кг/л} = 10 \text{ кг} = 10000 \text{ г}\]
4. Находим общую массу раствора:
\[m(\text{р-ра}) = m(\text{купороса}) + m(H_2O) = 500 + 10000 = 10500 \text{ г}\]
5. Вычисляем массовую долю соли в процентах:
\[\omega(CuSO_4) = \frac{m(CuSO_4)}{m(\text{р-ра})} \cdot 100\% = \frac{320}{10500} \cdot 100\% \approx 3,047\%\]
Округляем до целого числа, как требует условие: 3.
Ответ: 3.