schoolХимия
verifiedРешено AI
Решение задачи по химии: Вариант 11
help_outlineУсловие задачи
lightbulbКраткий ответ
Представлено подробное решение задачи по химии, включая уравнение реакции, расчет молярных масс веществ и определение теоретической атомной эффективности. Найдите пошаговое объяснение решения онлайн.
Подробное решение
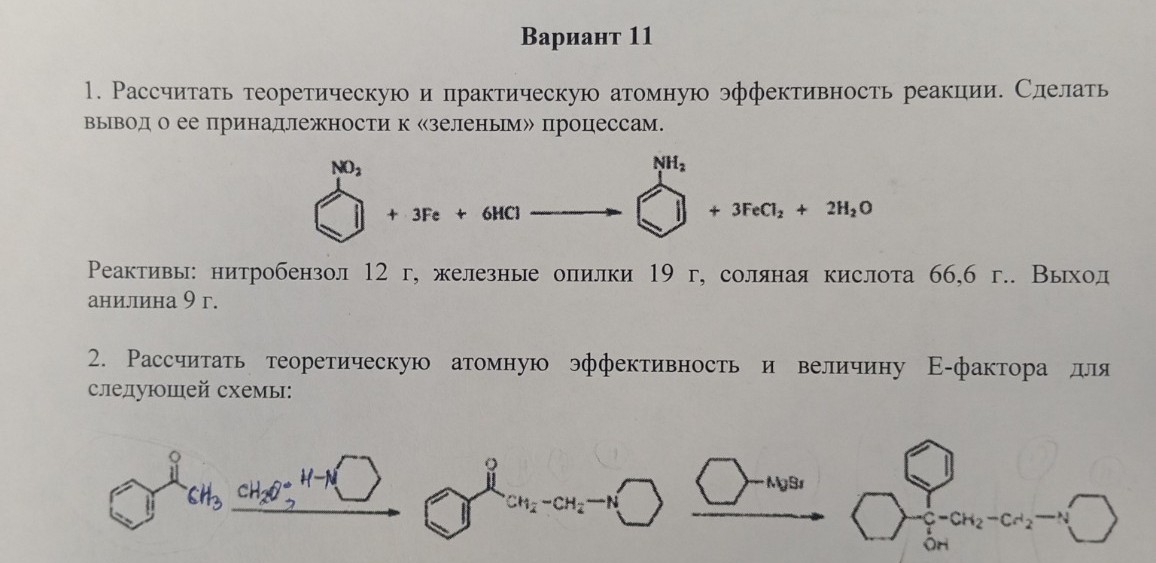
Вариант 11
Задача 1
Дано:
\( m(C_6H_5NO_2) = 12 \) г
\( m(Fe) = 19 \) г
\( m(HCl) = 66,6 \) г
\( m_{практ}(C_6H_5NH_2) = 9 \) г
Решение:
1. Уравнение реакции:
\[ C_6H_5NO_2 + 3Fe + 6HCl \rightarrow C_6H_5NH_2 + 3FeCl_2 + 2H_2O \]
2. Рассчитаем молярные массы веществ:
\( M(C_6H_5NO_2) = 12 \cdot 6 + 5 + 14 + 16 \cdot 2 = 123 \) г/моль
\( M(Fe) = 56 \) г/моль
\( M(HCl) = 36,5 \) г/моль
\( M(C_6H_5NH_2) = 12 \cdot 6 + 5 + 14 + 2 = 93 \) г/моль
\( M(FeCl_2) = 56 + 35,5 \cdot 2 = 127 \) г/моль
\( M(H_2O) = 18 \) г/моль
3. Теоретическая атомная эффективность (АЭ) рассчитывается как отношение молярной массы целевого продукта к сумме молярных масс всех реагентов согласно стехиометрии:
\[ AE_{теор} = \frac{M(целевого\ продукта)}{\sum M(реагентов)} \cdot 100\% \]
\[ AE_{теор} = \frac{93}{123 + 3 \cdot 56 + 6 \cdot 36,5} \cdot 100\% = \frac{93}{123 + 168 + 219} \cdot 100\% = \frac{93}{510} \cdot 100\% \approx 18,24\% \]
4. Практическая атомная эффективность (АЭ практ) учитывает реальные массы взятых веществ и выход продукта:
\[ AE_{практ} = \frac{m_{практ}(продукта)}{\sum m(реагентов)} \cdot 100\% \]
\[ AE_{практ} = \frac{9}{12 + 19 + 66,6} \cdot 100\% = \frac{9}{97,6} \cdot 100\% \approx 9,22\% \]
Вывод: Данный процесс характеризуется крайне низкой атомной эффективностью (менее 20%). Это связано с образованием большого количества побочных продуктов (солей железа и воды). Согласно принципам «зеленой химии», процесс не является экологически эффективным. В современной российской химической промышленности такие методы стараются заменять на каталитическое гидрирование, где единственным реагентом является водород, что минимизирует отходы.
Задача 2
Схема синтеза:
1) \( C_6H_5COCH_3 + CH_2O + C_5H_{11}N \rightarrow C_{14}H_{19}NO + H_2O \) (Реакция Манниха)
2) \( C_{14}H_{19}NO + C_6H_{11}MgBr \rightarrow C_{20}H_{31}NO \) (после гидролиза)
Для расчета теоретической АЭ и E-фактора рассмотрим суммарное уравнение процесса:
\( C_6H_5COCH_3 + CH_2O + C_5H_{11}N + C_6H_{11}MgBr + H_2O \rightarrow C_{20}H_{31}NO + Mg(OH)Br + H_2O \)
Целевой продукт: \( C_{20}H_{31}NO \)
Молярная масса продукта: \( M = 20 \cdot 12 + 31 \cdot 1 + 14 + 16 = 301 \) г/моль.
Реагенты:
1. Ацетофенон \( C_8H_8O \): \( M = 120 \) г/моль
2. Формальдегид \( CH_2O \): \( M = 30 \) г/моль
3. Пиперидин \( C_5H_{11}N \): \( M = 85 \) г/моль
4. Циклогексилмагнийбромид \( C_6H_{11}MgBr \): \( M = 83 + 24 + 80 = 187 \) г/моль
5. Вода (для стадии гидролиза): \( M = 18 \) г/моль
Сумма масс реагентов: \( \sum M = 120 + 30 + 85 + 187 + 18 = 440 \) г/моль.
1. Теоретическая атомная эффективность:
\[ AE = \frac{301}{440} \cdot 100\% \approx 68,41\% \]
2. E-фактор (отношение массы отходов к массе продукта):
Масса отходов = \( \sum M(реагентов) - M(продукта) = 440 - 301 = 139 \) г/моль.
\[ E = \frac{m(отходов)}{m(продукта)} = \frac{139}{301} \approx 0,46 \]
Ответ: \( AE \approx 68,41\% \), \( E \approx 0,46 \).