schoolХимия
verifiedРешено AI
Решение задачи №31: Расстановка коэффициентов методом электронного баланса
help_outlineУсловие задачи
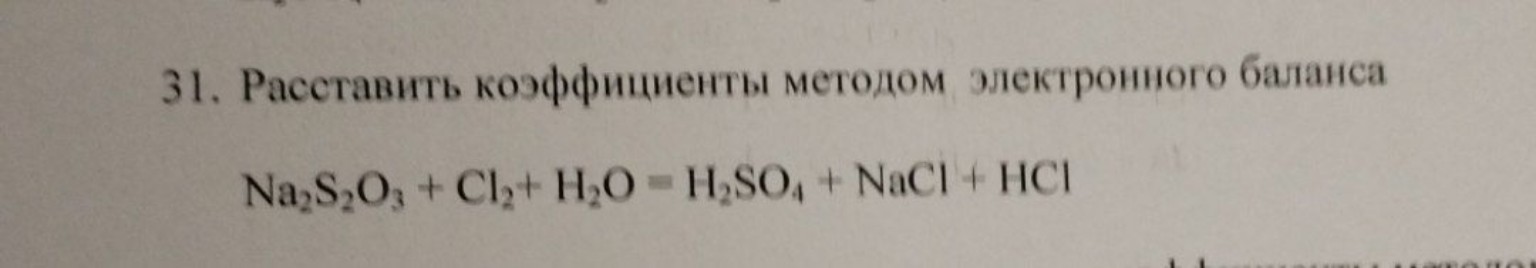
lightbulbКраткий ответ
В реакции тиосульфата натрия с хлором, сера окисляется, а хлор восстанавливается. Используя метод электронного баланса, можно расставить коэффициенты в уравнении реакции.
Подробное решение
Задание 31. Расставить коэффициенты методом электронного баланса
Для решения задачи определим степени окисления элементов, которые их меняют:
1. В тиосульфате натрия \(Na_{2}S_{2}O_{3}\) средняя степень окисления серы равна \(+2\). В серной кислоте \(H_{2}SO_{4}\) сера имеет степень окисления \(+6\).
2. Свободный хлор \(Cl_{2}\) имеет степень окисления \(0\). В хлоридах (\(NaCl\) и \(HCl\)) хлор имеет степень окисления \(-1\).
Составим схему электронного баланса:
\[2S^{+2} - 8e^{-} \rightarrow 2S^{+6} \quad | \quad 1 \text{ (окисление, сера — восстановитель)}\]
\[Cl_{2}^{0} + 2e^{-} \rightarrow 2Cl^{-1} \quad | \quad 4 \text{ (восстановление, хлор — окислитель)}\]
Пояснение: так как в молекуле \(Na_{2}S_{2}O_{3}\) два атома серы, мы учитываем их оба. Для перехода двух атомов из \(+2\) в \(+6\) требуется отдать 8 электронов. Чтобы сбалансировать заряды, перед хлором необходимо поставить коэффициент 4.
Переносим коэффициенты в уравнение:
\[Na_{2}S_{2}O_{3} + 4Cl_{2} + 5H_{2}O = 2H_{2}SO_{4} + 2NaCl + 6HCl\]
Проверка по элементам:
- Натрий (\(Na\)): 2 слева, 2 справа.
- Сера (\(S\)): 2 слева, 2 справа.
- Хлор (\(Cl\)): \(4 \cdot 2 = 8\) слева, \(2 + 6 = 8\) справа.
- Водород (\(H\)): \(5 \cdot 2 = 10\) слева, \(2 \cdot 2 + 6 = 10\) справа.
- Кислород (\(O\)): \(3 + 5 = 8\) слева, \(2 \cdot 4 = 8\) справа.
Уравнение составлено верно. Данная реакция демонстрирует сильные окислительные свойства хлора, которые широко используются в отечественной химической промышленности для очистки сточных вод и синтеза различных соединений.