schoolХимия
verifiedРешено AI
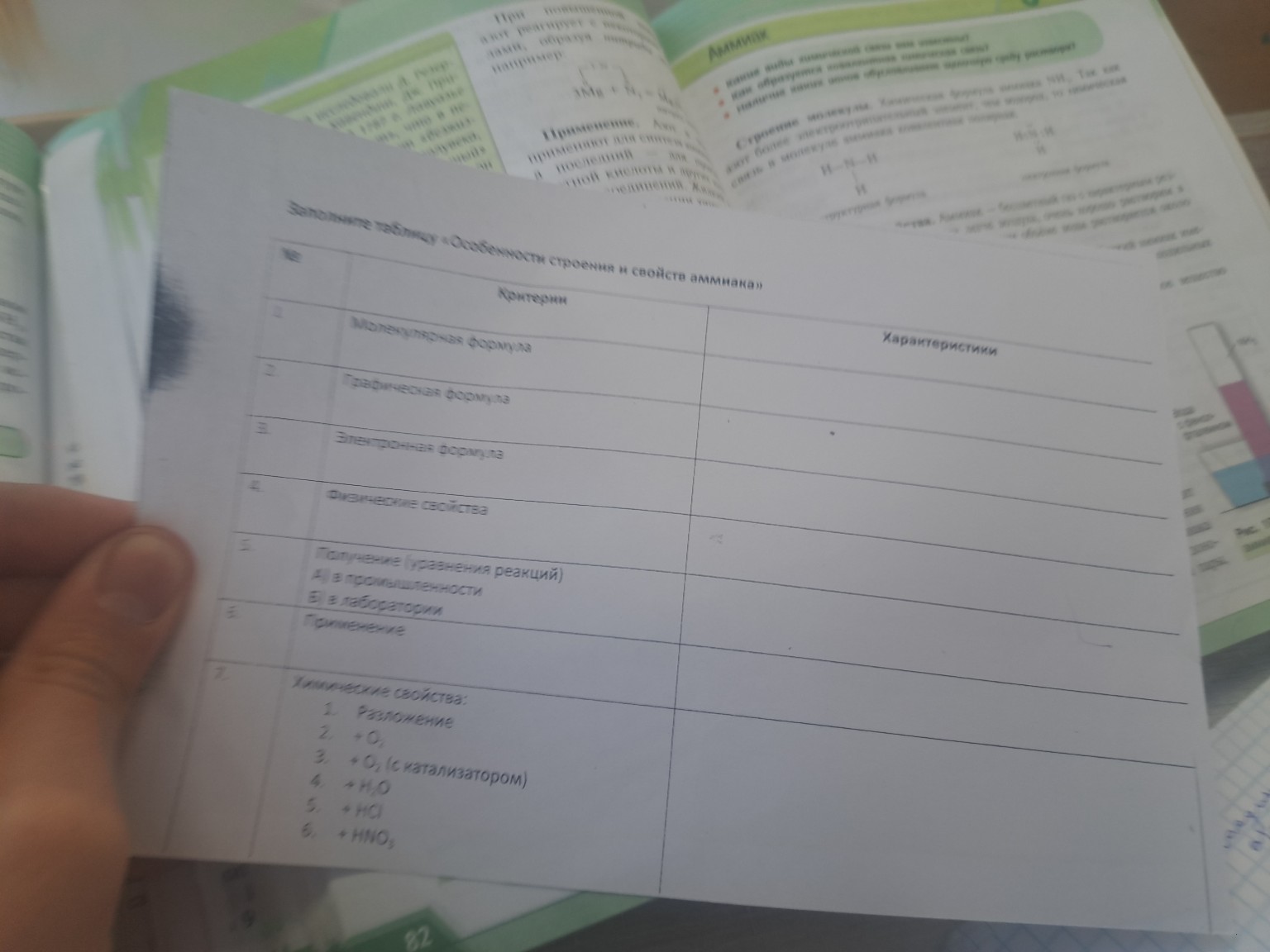
Особенности строения и свойств аммиака (NH3): Решение задачи
help_outlineУсловие задачи
lightbulbКраткий ответ
Представлено решение задачи по химии: заполненная таблица с молекулярной, структурной и электронной формулами аммиака, а также описанием его физических свойств. Готовое решение для тетради.
Подробное решение
Ниже представлено заполнение таблицы «Особенности строения и свойств аммиака», оформленное для удобного переписывания в тетрадь.
Таблица: Особенности строения и свойств аммиака
1. Молекулярная формула:
\( NH_{3} \)
2. Графическая (структурная) формула:
Азот связан с тремя атомами водорода одинарными ковалентными связями. У азота остается одна неподеленная электронная пара.
\[ H - \underset{\text{|} }{N} - H \]
\[ \text{ } \text{ } \text{ } H \]
3. Электронная формула:
Вокруг символа азота располагаются три общие электронные пары с водородом и одна собственная неподеленная пара электронов.
\[ H : \underset{\cdot \cdot}{\ddot{N}} : H \]
\[ \text{ } \text{ } \text{ } \cdot \cdot \]
\[ \text{ } \text{ } \text{ } H \]
4. Физические свойства:
Бесцветный газ с резким характерным запахом (запах нашатырного спирта). Почти в два раза легче воздуха. Очень хорошо растворим в воде (в 1 объеме воды растворяется около 700 объемов аммиака). При охлаждении или повышении давления легко сжижается.
5. Получение (уравнения реакций):
А) В промышленности (синтез Габера):
\[ N_{2} + 3H_{2} \rightleftarrows 2NH_{3} + Q \]
Б) В лаборатории (взаимодействие солей аммония со щелочами при нагревании):
\[ 2NH_{4}Cl + Ca(OH)_{2} \xrightarrow{t} CaCl_{2} + 2NH_{3}\uparrow + 2H_{2}O \]
6. Применение:
Производство азотных удобрений (аммиачная селитра, мочевина), производство азотной кислоты, взрывчатых веществ. Используется в холодильных установках как хладагент. В медицине применяется в виде нашатырного спирта.
7. Химические свойства:
1. Разложение (при сильном нагревании):
\[ 2NH_{3} \xrightarrow{t} N_{2} + 3H_{2} \]
2. Горение в кислороде (без катализатора):
\[ 4NH_{3} + 3O_{2} \rightarrow 2N_{2} + 6H_{2}O \]
3. Окисление кислородом (с катализатором Pt):
\[ 4NH_{3} + 5O_{2} \xrightarrow{Pt, t} 4NO + 6H_{2}O \]
4. Взаимодействие с водой (образование гидрата аммиака):
\[ NH_{3} + H_{2}O \rightleftarrows NH_{3} \cdot H_{2}O \rightleftarrows NH_{4}^{+} + OH^{-} \]
5. Взаимодействие с соляной кислотой:
\[ NH_{3} + HCl \rightarrow NH_{4}Cl \]
6. Взаимодействие с азотной кислотой:
\[ NH_{3} + HNO_{3} \rightarrow NH_{4}NO_{3} \]