schoolМатематика
verifiedРешено AI
Решение задачи по термодинамике: Расчет энтальпии реакции
help_outlineУсловие задачи
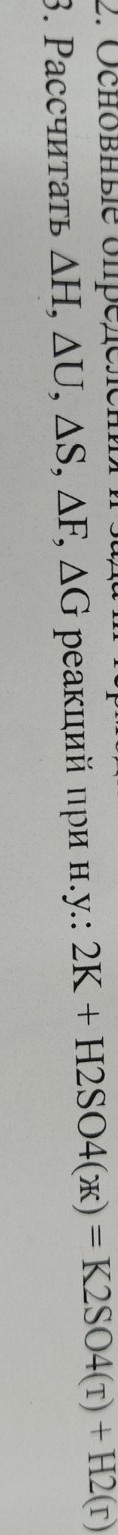
lightbulbКраткий ответ
Изменение энтальпии реакции 2K + H2SO4 = K2SO4 + H2 равно -623,7 кДж. Расчет произведен с использованием стандартных энтальпий образования веществ при стандартных условиях.
Подробное решение
Для решения данной задачи по термодинамике нам понадобятся справочные данные для участников реакции при стандартных условиях (н.у. принимаем за \(T = 298,15\) К).
Уравнение реакции:
\[ 2K_{(т)} + H_2SO_4(ж) = K_2SO_4(т) + H_2(г) \]
Выпишем стандартные энтальпии образования \(\Delta H_f^0\) (кДж/моль) и стандартные энтропии \(S^0\) (Дж/(моль·К)):
1. \(K_{(т)}\): \(\Delta H_f^0 = 0\); \(S^0 = 64,67\)
2. \(H_2SO_4(ж)\): \(\Delta H_f^0 = -814,0\); \(S^0 = 156,9\)
3. \(K_2SO_4(т)\): \(\Delta H_f^0 = -1437,7\); \(S^0 = 175,6\)
4. \(H_2(г)\): \(\Delta H_f^0 = 0\); \(S^0 = 130,5\)
1. Расчет изменения энтальпии \(\Delta H^0\):
\[ \Delta H^0 = \sum \Delta H_{f, прод}^0 - \sum \Delta H_{f, исх}^0 \]
\[ \Delta H^0 = [(-1437,7) + 0] - [2 \cdot 0 + (-814,0)] = -1437,7 + 814,0 = -623,7 \text{ кДж} \]
2. Расчет изменения энтропии \(\Delta S^0\):
\[ \Delta S^0 = \sum S_{прод}^0 - \sum S_{исх}^0 \]
\[ \Delta S^0 = [175,6 + 130,5] - [2 \cdot 64,67 + 156,9] = 306,1 - 286,24 = 19,86 \text{ Дж/К} = 0,01986 \text{ кДж/К} \]
3. Расчет изменения энергии Гиббса \(\Delta G^0\):
\[ \Delta G^0 = \Delta H^0 - T \cdot \Delta S^0 \]
\[ \Delta G^0 = -623,7 - 298,15 \cdot 0,01986 = -623,7 - 5,92 = -629,62 \text{ кДж} \]
4. Расчет изменения внутренней энергии \(\Delta U^0\):
Связь энтальпии и внутренней энергии: \(\Delta H = \Delta U + \Delta n \cdot R \cdot T\), где \(\Delta n\) — изменение количества вещества газов.
В реакции участвует 1 моль газа (\(H_2\)) в продуктах, реагенты — твердые и жидкие.
\[ \Delta n = 1 - 0 = 1 \]
\[ \Delta U^0 = \Delta H^0 - \Delta n \cdot R \cdot T \]
Используем \(R = 8,314 \cdot 10^{-3}\) кДж/(моль·К):
\[ \Delta U^0 = -623,7 - 1 \cdot 8,314 \cdot 10^{-3} \cdot 298,15 = -623,7 - 2,48 = -626,18 \text{ кДж} \]
5. Расчет изменения энергии Гельмгольца \(\Delta F^0\):
\[ \Delta F^0 = \Delta U^0 - T \cdot \Delta S^0 \]
\[ \Delta F^0 = -626,18 - 298,15 \cdot 0,01986 = -626,18 - 5,92 = -632,1 \text{ кДж} \]
Ответ:
\(\Delta H^0 = -623,7\) кДж;
\(\Delta U^0 = -626,18\) кДж;
\(\Delta S^0 = 19,86\) Дж/К;
\(\Delta G^0 = -629,62\) кДж;
\(\Delta F^0 = -632,1\) кДж.