schoolМатематика
verifiedРешено AI
Решение задачи: Найти массу раствора FeCl2 для получения 0.4 моль AgCl
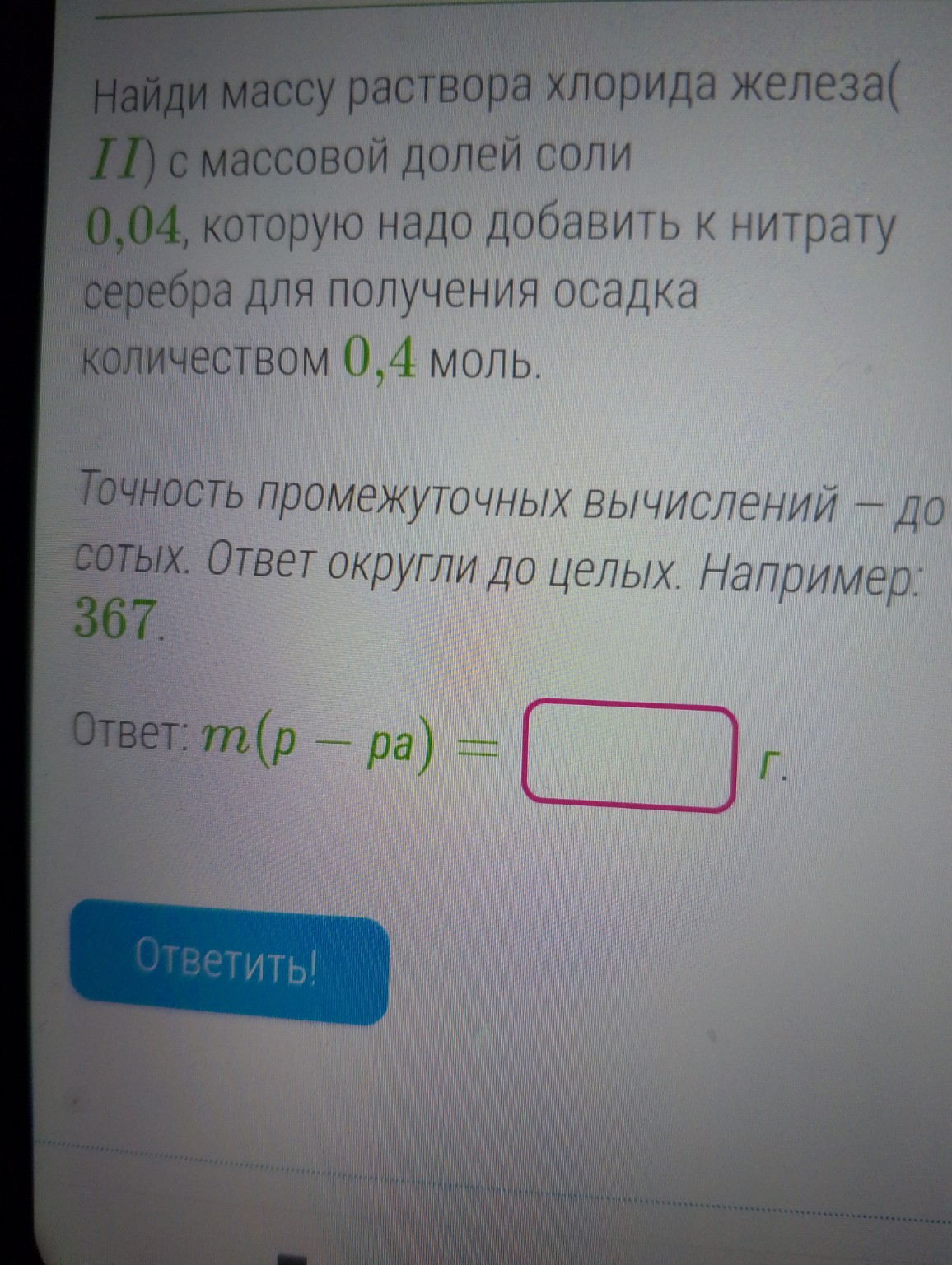
help_outlineУсловие задачи
lightbulbКраткий ответ
Для получения 0.4 моль осадка AgCl необходимо добавить раствор хлорида железа(II) массой примерно 635 грамм. В решении показаны все этапы вычислений и уравнение реакции.
Подробное решение
Задание: Найди массу раствора хлорида железа(\(II\)) с массовой долей соли \(0,04\), которую надо добавить к нитрату серебра для получения осадка количеством \(0,4\) моль.
Решение для записи в тетрадь:
1. Составим уравнение химической реакции:
\[FeCl_{2} + 2AgNO_{3} \rightarrow Fe(NO_{3})_{2} + 2AgCl\downarrow\]
Осадком в данной реакции является хлорид серебра \(AgCl\).
2. По условию количество вещества осадка \(n(AgCl) = 0,4\) моль.
По уравнению реакции определим количество вещества хлорида железа(\(II\)):
\[n(FeCl_{2}) = \frac{1}{2} n(AgCl) = \frac{0,4}{2} = 0,2 \text{ моль}\]
3. Вычислим молярную массу хлорида железа(\(II\)):
\[M(FeCl_{2}) = 56 + 35,5 \cdot 2 = 56 + 71 = 127 \text{ г/моль}\]
4. Найдем массу чистой соли \(FeCl_{2}\):
\[m(FeCl_{2}) = n(FeCl_{2}) \cdot M(FeCl_{2}) = 0,2 \cdot 127 = 25,4 \text{ г}\]
5. Вычислим массу раствора, используя массовую долю (\(\omega = 0,04\)):
\[m(p-pa) = \frac{m(FeCl_{2})}{\omega} = \frac{25,4}{0,04} = 635 \text{ г}\]
Ответ: \(m(p-pa) = 635\) г.