schoolФизика
verifiedРешено AI
Уравнение Ван-дер-Ваальса: Решение задачи 3
help_outlineУсловие задачи
lightbulbКраткий ответ
Уравнение Ван-дер-Ваальса учитывает силы межмолекулярного взаимодействия и собственный объем молекул реального газа. Оно имеет вид: (p + a/v^2)(v - b) = RT.
Подробное решение
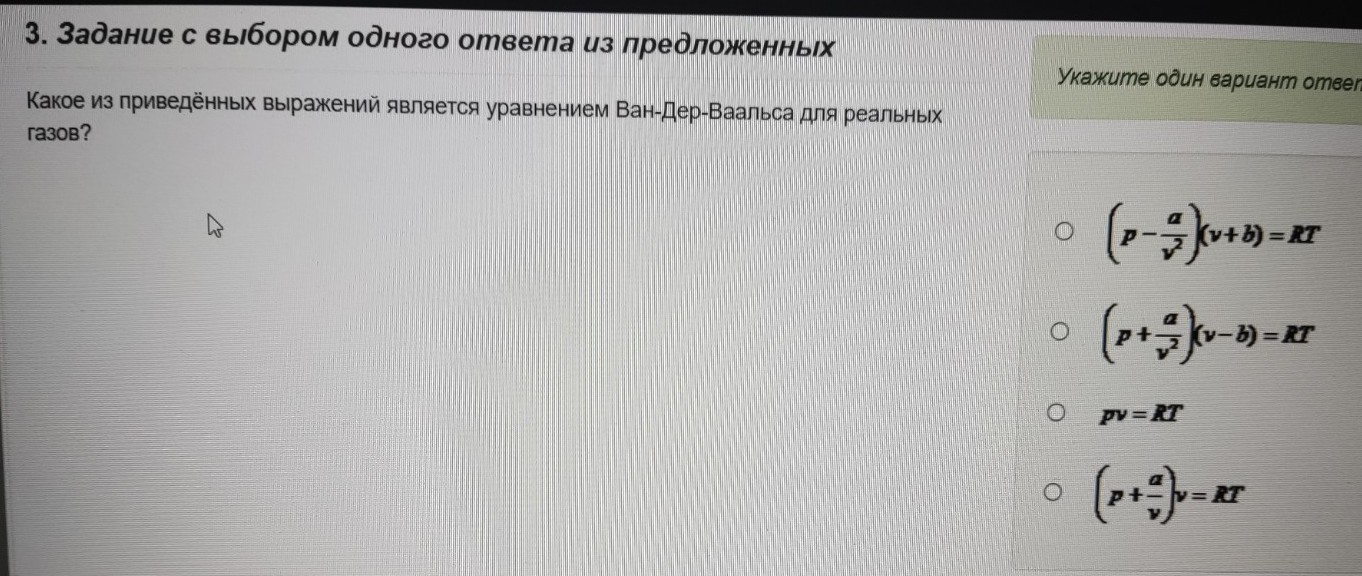
Задание 3.
Вопрос: Какое из приведенных выражений является уравнением Ван-дер-Ваальса для реальных газов?
Решение:
Уравнение Ван-дер-Ваальса учитывает силы межмолекулярного взаимодействия и собственный объем молекул реального газа. Для одного моля (или единицы массы при использовании соответствующих констант) оно записывается следующим образом:
\[ \left( p + \frac{a}{v^2} \right) (v - b) = RT \]
Где:
\( p \) — давление газа;
\( v \) — удельный объем;
\( a \) — поправка, учитывающая силы притяжения между молекулами (внутреннее давление);
\( b \) — поправка, учитывающая собственный объем молекул газа;
\( R \) — газовая постоянная;
\( T \) — абсолютная температура.
Разберем структуру формулы:
1. К давлению \( p \) прибавляется слагаемое \( \frac{a}{v^2} \), так как силы притяжения молекул создают дополнительное внутреннее давление.
2. Из объема \( v \) вычитается объем \( b \), так как молекулы не являются точечными и занимают определенное пространство, недоступное для движения других молекул.
Среди предложенных вариантов верным является второй сверху.
Ответ: \( \left( p + \frac{a}{v^2} \right) (v - b) = RT \)