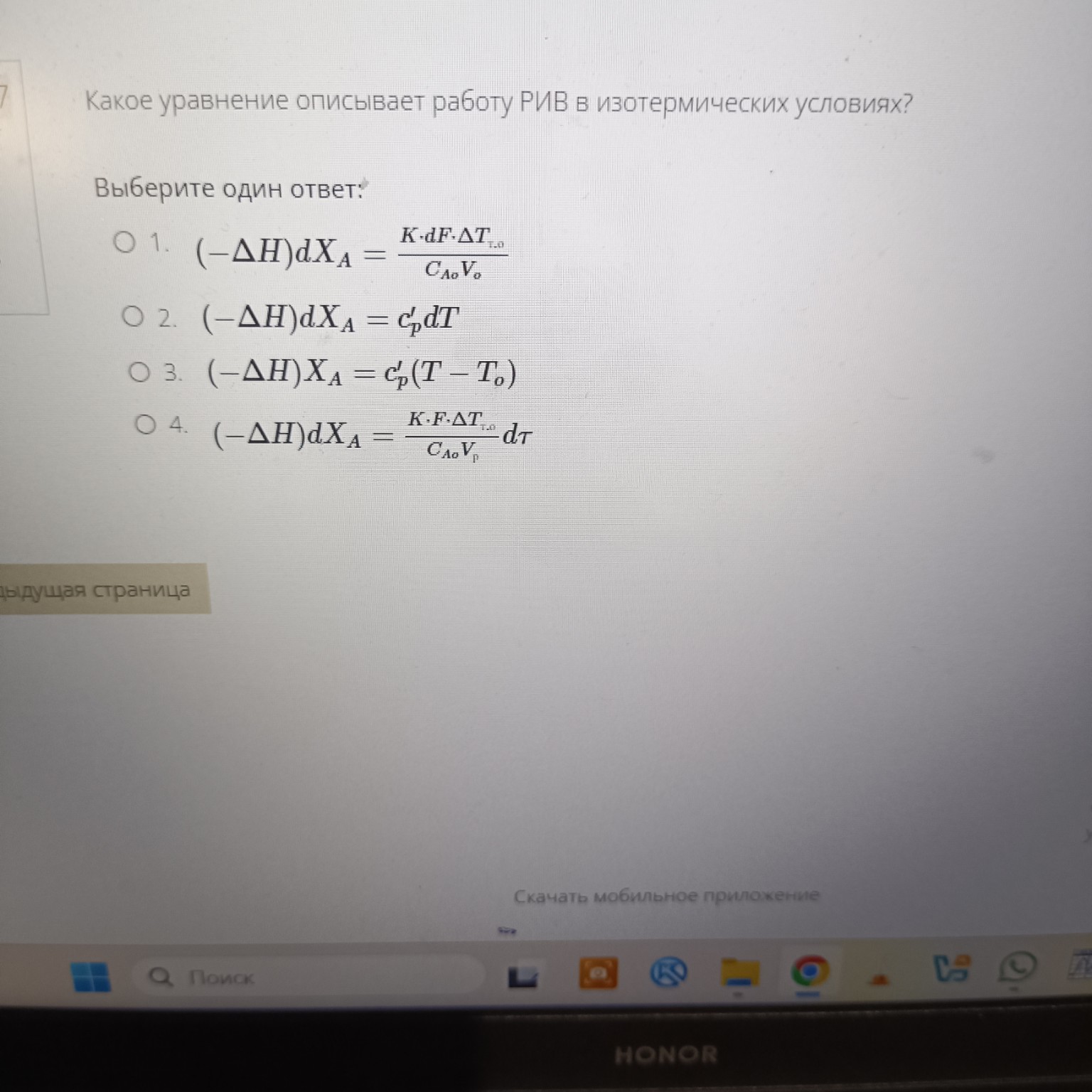
Задача:
Какое уравнение описывает работу РИВ в изотермических условиях?
Выберите один ответ:
- \( (-\Delta H)dX_A = \frac{K \cdot dF \cdot \Delta T_{т.о}}{C_{Ao}V_o} \)
- \( (-\Delta H)dX_A = c'_p dT \)
- \( (-\Delta H)X_A = c'_p (T - T_o) \)
- \( (-\Delta H)dX_A = \frac{K \cdot F \cdot \Delta T_{т.о}}{C_{Ao}V_p} dT \)
Решение:
Давайте разберем условия задачи и смысл каждого уравнения.
1. Что такое РИВ?
РИВ – это Реактор Идеального Вытеснения (или трубчатый реактор). В таком реакторе реакционная смесь движется как поршень, без продольного перемешивания. Это проточный реактор.
2. Что такое изотермические условия?
Изотермические условия означают, что температура в реакторе поддерживается постоянной (\(T = \text{const}\)). Это очень важное условие, так как оно влияет на тепловой баланс.
3. Общее уравнение теплового баланса для проточного реактора:
Для дифференциального объема проточного реактора (такого как РИВ) общее уравнение теплового баланса можно записать как:
\[ \text{Тепло, выделяемое реакцией} + \text{Тепло, поступающее/отводимое через стенки} = \text{Изменение энтальпии потока} \]
В дифференциальной форме это часто выглядит так:
\[ (-\Delta H) \cdot (-r_A) \cdot dV + dQ_{т.о} = F_A \cdot c_p \cdot dT \]
Где:
- \(-\Delta H\) – тепловой эффект реакции (для экзотермической реакции \(\Delta H < 0\), поэтому \(-\Delta H > 0\)).
- \(-r_A\) – скорость расходования реагента А.
- \(dV\) – дифференциальный объем реактора.
- \(dQ_{т.о}\) – дифференциальное количество тепла, поступающего или отводимого через стенки реактора.
- \(F_A\) – молярный расход реагента А.
- \(c_p\) – молярная теплоемкость.
- \(dT\) – изменение температуры.
4. Применение условия изотермичности:
Если процесс протекает в изотермических условиях, это означает, что температура не меняется, то есть \(dT = 0\). Следовательно, член, отвечающий за изменение энтальпии потока, становится равным нулю:
\[ F_A \cdot c_p \cdot dT = 0 \]
Тогда уравнение теплового баланса упрощается до:
\[ (-\Delta H) \cdot (-r_A) \cdot dV + dQ_{т.о} = 0 \]
Это означает, что все тепло, выделяемое или поглощаемое реакцией, должно быть компенсировано теплообменом через стенки реактора, чтобы температура оставалась постоянной.
5. Выражение \(dQ_{т.о}\):
Теплообмен через стенки реактора обычно описывается уравнением:
\[ dQ_{т.о} = K \cdot \Delta T_{т.о} \cdot dF \]
Где:
- \(K\) – коэффициент теплопередачи.
- \(\Delta T_{т.о}\) – разность температур между реакционной смесью и теплоносителем.
- \(dF\) – дифференциальная площадь поверхности теплообмена.
6. Переход к степени превращения \(dX_A\):
Скорость реакции \(-r_A\) связана со степенью превращения \(X_A\) следующим образом:
\[ -r_A = C_{Ao} \frac{dX_A}{d\tau} \]
Или, для проточного реактора, где \(dV = V_o d\tau\), где \(V_o\) - объемный расход, а \(d\tau\) - дифференциальное время пребывания:
\[ -r_A dV = F_{Ao} dX_A \]
Где \(F_{Ao} = C_{Ao} V_o\) – начальный молярный расход реагента А.
Подставляя это в упрощенное уравнение теплового баланса:
\[ (-\Delta H) F_{Ao} dX_A + K \cdot \Delta T_{т.о} \cdot dF = 0 \]
\[ (-\Delta H) F_{Ao} dX_A = - K \cdot \Delta T_{т.о} \cdot dF \]
Или, если мы хотим выразить \(dX_A\):
\[ (-\Delta H) dX_A = - \frac{K \cdot \Delta T_{т.о} \cdot dF}{F_{Ao}} \]
Заметим, что \(F_{Ao} = C_{Ao} V_o\).
\[ (-\Delta H) dX_A = - \frac{K \cdot \Delta T_{т.о} \cdot dF}{C_{Ao}V_o} \]
Знак минус перед правой частью означает, что если реакция экзотермическая (\(-\Delta H > 0\)), то тепло должно отводиться (\(K \cdot \Delta T_{т.о} \cdot dF > 0\), если \(\Delta T_{т.о}\) – это разность температур реакция-теплоноситель, и теплоноситель холоднее). Если реакция эндотермическая (\(-\Delta H < 0\)), то тепло должно подводиться.
Теперь рассмотрим предложенные варианты:
- \( (-\Delta H)dX_A = \frac{K \cdot dF \cdot \Delta T_{т.о}}{C_{Ao}V_o} \) – Этот вариант очень похож на наше выведенное уравнение, за исключением знака. Если принять, что \(\Delta T_{т.о}\) уже учитывает направление теплового потока (например, если тепло отводится, то \(K \cdot dF \cdot \Delta T_{т.о}\) будет отрицательным, и тогда уравнение будет верным). Или, если в правой части подразумевается абсолютное значение теплового потока, который должен быть равен теплу реакции.
- \( (-\Delta H)dX_A = c'_p dT \) – Этот вариант описывает изменение температуры за счет реакции, но в изотермических условиях \(dT = 0\), поэтому он не подходит.
- \( (-\Delta H)X_A = c'_p (T - T_o) \) – Это уравнение для интегрального теплового баланса, также описывающее изменение температуры, что противоречит изотермическим условиям.
- \( (-\Delta H)dX_A = \frac{K \cdot F \cdot \Delta T_{т.о}}{C_{Ao}V_p} dT \) – Этот вариант также содержит \(dT\), что противоречит изотермическим условиям.
Единственный вариант, который не содержит \(dT\) и описывает баланс между теплом реакции и теплообменом, это первый вариант. Разница в знаке может быть связана с определением \(\Delta T_{т.о}\) или с тем, что в уравнении подразумевается равенство абсолютных значений тепловых потоков.
В контексте изотермических условий, когда \(dT=0\), тепло, выделяемое или поглощаемое реакцией, должно быть полностью компенсировано теплообменом. Тепло, выделяемое реакцией в дифференциальном объеме: \(dQ_{реакции} = (-\Delta H) F_{Ao} dX_A\). Тепло, отводимое через стенки: \(dQ_{отвод} = K \cdot dF \cdot \Delta T_{т.о}\). Для изотермического режима \(dQ_{реакции} = dQ_{отвод}\).
\[ (-\Delta H) F_{Ao} dX_A = K \cdot dF \cdot \Delta T_{т.о} \]
Разделив на \(F_{Ao} = C_{Ao}V_o\), получаем:
\[ (-\Delta H) dX_A = \frac{K \cdot dF \cdot \Delta T_{т.о}}{C_{Ao}V_o} \]
Это точно соответствует первому варианту.
Ответ:
Правильный ответ: \( (-\Delta H)dX_A = \frac{K \cdot dF \cdot \Delta T_{т.о}}{C_{Ao}V_o} \).