school
Общие знания
verified
Решено AI
Окислительно-восстановительные реакции (ОВР): Решение
help_outline
Условие задачи
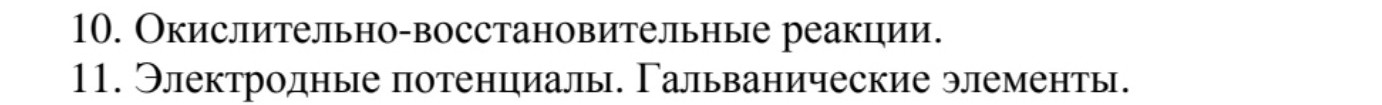
lightbulb
Краткий ответ
Окислительно-восстановительные реакции (ОВР) - это реакции с изменением степеней окисления атомов. В ходе ОВР происходит перенос электронов между веществами.
Подробное решение
Вот ответы на вопросы, оформленные так, чтобы их было удобно переписать в тетрадь школьнику.
10. Окислительно-восстановительные реакции.
Окислительно-восстановительные реакции (ОВР) – это химические реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих веществ. Это означает, что в ходе реакции происходит перенос электронов от одного атома к другому.
Основные понятия:
* Окисление – это процесс отдачи электронов атомом, в результате чего его степень окисления повышается. Вещество, которое отдает электроны, называется восстановителем.
* Восстановление – это процесс присоединения электронов атомом, в результате чего его степень окисления понижается. Вещество, которое принимает электроны, называется окислителем.
* Окислитель – это вещество, которое принимает электроны и при этом восстанавливается.
* Восстановитель – это вещество, которое отдает электроны и при этом окисляется.
Пример:
Рассмотрим реакцию взаимодействия меди с азотной кислотой:
\[ \text{Cu} + 4\text{HNO}_3 \rightarrow \text{Cu(NO}_3)_2 + 2\text{NO}_2 + 2\text{H}_2\text{O} \]
Определим степени окисления элементов:
* В \(\text{Cu}\) (металл) степень окисления равна 0.
* В \(\text{HNO}_3\): \(\text{H}^{+1}\), \(\text{O}^{-2}\), значит, \(\text{N}^{+5}\) (\(1 + x + 3 \cdot (-2) = 0 \Rightarrow x = +5\)).
* В \(\text{Cu(NO}_3)_2\): \(\text{Cu}^{+2}\), \(\text{O}^{-2}\), значит, \(\text{N}^{+5}\) (\(2 + 2 \cdot (x + 3 \cdot (-2)) = 0 \Rightarrow 2 + 2x - 12 = 0 \Rightarrow 2x = 10 \Rightarrow x = +5\)).
* В \(\text{NO}_2\): \(\text{O}^{-2}\), значит, \(\text{N}^{+4}\) (\(x + 2 \cdot (-2) = 0 \Rightarrow x = +4\)).
* В \(\text{H}_2\text{O}\): \(\text{H}^{+1}\), \(\text{O}^{-2}\).
Изменения степеней окисления:
* Медь: \(\text{Cu}^0 \rightarrow \text{Cu}^{+2}\). Медь отдала 2 электрона, она окислилась, является восстановителем.
\[ \text{Cu}^0 - 2\text{e}^- \rightarrow \text{Cu}^{+2} \]
* Азот: \(\text{N}^{+5} \rightarrow \text{N}^{+4}\). Азот принял 1 электрон, он восстановился, является окислителем.
\[ \text{N}^{+5} + 1\text{e}^- \rightarrow \text{N}^{+4} \]
Составление электронного баланса:
Для уравнивания числа отданных и принятых электронов, найдем наименьшее общее кратное (НОК) для 2 и 1, это 2.
* \(\text{Cu}^0 - 2\text{e}^- \rightarrow \text{Cu}^{+2} \quad | \quad 1\) (коэффициент перед медью)
* \(\text{N}^{+5} + 1\text{e}^- \rightarrow \text{N}^{+4} \quad | \quad 2\) (коэффициент перед азотом в \(\text{NO}_2\))
Расставляем коэффициенты в уравнении:
\[ 1\text{Cu} + \text{HNO}_3 \rightarrow 1\text{Cu(NO}_3)_2 + 2\text{NO}_2 + \text{H}_2\text{O} \]
Теперь уравняем количество атомов азота в левой части. В правой части: 2 атома азота в \(\text{Cu(NO}_3)_2\) и 2 атома азота в \(2\text{NO}_2\), итого 4 атома азота. Значит, перед \(\text{HNO}_3\) ставим коэффициент 4.
\[ \text{Cu} + 4\text{HNO}_3 \rightarrow \text{Cu(NO}_3)_2 + 2\text{NO}_2 + \text{H}_2\text{O} \]
Уравняем количество атомов водорода. В левой части 4 атома водорода (в \(4\text{HNO}_3\)). В правой части должно быть 4 атома водорода, значит, перед \(\text{H}_2\text{O}\) ставим коэффициент 2.
\[ \text{Cu} + 4\text{HNO}_3 \rightarrow \text{Cu(NO}_3)_2 + 2\text{NO}_2 + 2\text{H}_2\text{O} \]
Проверим количество атомов кислорода:
Слева: \(4 \cdot 3 = 12\) атомов кислорода.
Справа: \(3 \cdot 2 = 6\) (в \(\text{Cu(NO}_3)_2\)) \(+ 2 \cdot 2 = 4\) (в \(2\text{NO}_2\)) \(+ 2 \cdot 1 = 2\) (в \(2\text{H}_2\text{O}\)) \( = 6 + 4 + 2 = 12\) атомов кислорода.
Уравнение сбалансировано.
11. Электродные потенциалы. Гальванические элементы.
Электродный потенциал – это разность электрических потенциалов, возникающая на границе раздела фаз между электродом (металлом или другим проводником) и раствором электролита, в который он погружен. Эта разность потенциалов возникает из-за перехода ионов металла в раствор или осаждения ионов из раствора на металл, а также из-за перехода электронов.
Стандартный электродный потенциал (\(E^0\)) – это электродный потенциал, измеренный при стандартных условиях: температура 298 K (25 °C), концентрация ионов в растворе 1 моль/л, парциальное давление газов 1 атмосфера. Стандартный водородный электрод (СВЭ) принят за точку отсчета с потенциалом, равным 0 В.
Ряд стандартных электродных потенциалов (ряд активности металлов) – это последовательность металлов, расположенных в порядке возрастания их стандартных электродных потенциалов. Чем ниже потенциал, тем легче металл отдает электроны (является более сильным восстановителем).
Гальванические элементы (химические источники тока) – это устройства, в которых химическая энергия окислительно-восстановительной реакции превращается в электрическую энергию. Они состоят из двух различных электродов, погруженных в растворы электролитов, соединенных между собой солевым мостиком (для поддержания электронейтральности) и внешним проводником.
Принцип работы гальванического элемента:
В гальваническом элементе протекает самопроизвольная окислительно-восстановительная реакция. Электрод, на котором происходит окисление (отдача электронов), называется анодом (отрицательный полюс). Электрод, на котором происходит восстановление (прием электронов), называется катодом (положительный полюс). Электроны движутся по внешнему проводнику от анода к катоду, создавая электрический ток.
Пример: Гальванический элемент Даниэля-Якоби (медно-цинковый элемент).
Он состоит из цинкового электрода, погруженного в раствор сульфата цинка (\(\text{ZnSO}_4\)), и медного электрода, погруженного в раствор сульфата меди (\(\text{CuSO}_4\)). Растворы соединены солевым мостиком, а электроды – внешним проводником.
Стандартные электродные потенциалы:
* \(\text{Zn}^{2+} + 2\text{e}^- \rightarrow \text{Zn} \quad E^0 = -0.76 \text{ В}\)
* \(\text{Cu}^{2+} + 2\text{e}^- \rightarrow \text{Cu} \quad E^0 = +0.34 \text{ В}\)
Поскольку цинк имеет более отрицательный потенциал, он будет окисляться (отдавать электроны), а медь будет восстанавливаться (принимать электроны).
Процессы на электродах:
* Анод (отрицательный полюс, окисление):
\[ \text{Zn} - 2\text{e}^- \rightarrow \text{Zn}^{2+} \]
* Катод (положительный полюс, восстановление):
\[ \text{Cu}^{2+} + 2\text{e}^- \rightarrow \text{Cu} \]
Суммарная реакция в гальваническом элементе:
\[ \text{Zn} + \text{Cu}^{2+} \rightarrow \text{Zn}^{2+} + \text{Cu} \]
ЭДС (электродвижущая сила) гальванического элемента:
ЭДС элемента рассчитывается как разность потенциалов катода и анода:
\[ \text{ЭДС} = E^0_{\text{катода}} - E^0_{\text{анода}} \]
Для элемента Даниэля-Якоби:
\[ \text{ЭДС} = E^0_{\text{Cu}^{2+}/\text{Cu}} - E^0_{\text{Zn}^{2+}/\text{Zn}} = (+0.34 \text{ В}) - (-0.76 \text{ В}) = +1.10 \text{ В} \]
Положительное значение ЭДС указывает на самопроизвольность протекания реакции.