schoolХимия
verifiedРешено AI
Гидролиз: Определение, Типы и Примеры
help_outlineУсловие задачи
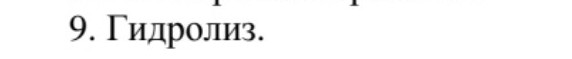
lightbulbКраткий ответ
Гидролиз - это реакция взаимодействия вещества с водой, приводящая к его разложению. В процессе гидролиза молекула воды расщепляется, а её части присоединяются к продуктам реакции.
Подробное решение
9. Гидролиз.
Гидролиз — это химическая реакция взаимодействия вещества с водой, при которой происходит разложение этого вещества на более простые компоненты. В ходе гидролиза молекула воды расщепляется, и её фрагменты (обычно \(H^+\) и \(OH^-\)) присоединяются к продуктам разложения.
Гидролиз может быть:
* Кислотным: происходит в присутствии кислоты, которая выступает в роли катализатора.
* Щелочным: происходит в присутствии щелочи, которая также является катализатором.
* Ферментативным: катализируется ферментами (биологическими катализаторами).
Примеры гидролиза:
1. Гидролиз солей:
* Соли, образованные сильной кислотой и слабым основанием (например, хлорид аммония \(NH_4Cl\)):
\[NH_4Cl + H_2O \rightleftharpoons NH_4OH + HCl\]
В растворе \(NH_4OH\) (гидроксид аммония) является слабым основанием, а \(HCl\) (соляная кислота) — сильной кислотой. Раствор будет иметь кислую реакцию из-за избытка ионов \(H^+\).
* Соли, образованные слабой кислотой и сильным основанием (например, ацетат натрия \(CH_3COONa\)):
\[CH_3COONa + H_2O \rightleftharpoons CH_3COOH + NaOH\]
В растворе \(CH_3COOH\) (уксусная кислота) является слабой кислотой, а \(NaOH\) (гидроксид натрия) — сильным основанием. Раствор будет иметь щелочную реакцию из-за избытка ионов \(OH^-\).
* Соли, образованные слабой кислотой и слабым основанием (например, ацетат аммония \(CH_3COONH_4\)):
\[CH_3COONH_4 + H_2O \rightleftharpoons CH_3COOH + NH_4OH\]
Реакция среды в этом случае зависит от относительной силы кислоты и основания.
* Соли, образованные сильной кислотой и сильным основанием (например, хлорид натрия \(NaCl\)):
\[NaCl + H_2O \rightleftharpoons NaOH + HCl\]
Гидролиз практически не происходит, так как образуются сильные электролиты, которые полностью диссоциируют. Раствор имеет нейтральную реакцию.
2. Гидролиз органических веществ:
* Эфиры:
\[R-COO-R' + H_2O \rightleftharpoons R-COOH + R'-OH\]
Например, гидролиз этилацетата:
\[CH_3COOC_2H_5 + H_2O \rightleftharpoons CH_3COOH + C_2H_5OH\]
(этилацетат + вода \(\rightleftharpoons\) уксусная кислота + этанол)
* Углеводы (например, сахароза):
\[C_{12}H_{22}O_{11} + H_2O \rightleftharpoons C_6H_{12}O_6 + C_6H_{12}O_6\]
(сахароза + вода \(\rightleftharpoons\) глюкоза + фруктоза)
* Белки:
Белки представляют собой полимеры, состоящие из аминокислот. При гидролизе белки распадаются на отдельные аминокислоты.
\[\text{Белок} + nH_2O \rightleftharpoons n \cdot \text{Аминокислота}\]
* Жиры (триглицериды):
\[\text{Жир} + 3H_2O \rightleftharpoons \text{Глицерин} + 3 \cdot \text{Жирная кислота}\]
Значение гидролиза:
Гидролиз играет важную роль во многих природных процессах (например, пищеварение, разложение органических веществ в почве) и в промышленности (производство мыла, сахара, спиртов).